
| A. | AgNO3 | B. | CuSO4 | C. | NaOH | D. | NaCl |
分析 电解结束后,向剩余电解液中加适量水,能使溶液和电解前相同,应为电解水型的电解,电解时阳极反应为:4OH--4e-=2H2O+O2↑,阴极反应为:4H++4e-=2H2↑,可为电解含氧酸溶液、强碱溶液或活泼金属的含氧酸盐溶液,以此解答该题.
解答 解:A.电解AgNO3,阳极析出O2,阴极生成Ag,要使溶液恢复到原来的浓度,应加入Ag2O,故A错误;
B.电解CuSO4,阳极生成O2,阴极生成Cu,要使溶液恢复到原来的浓度,应加入CuO,故B错误;
C.电解NaOH,阳极生成氧气,阴极生成氢气,实际为电解水,电解后加入水可恢复到原来的浓度,故C正确;
D.电解NaCl,生成NaOH、H2、Cl2,加盐酸显然不能恢复电解前的状态,应通入适量的HCl气体,故D错误.
故选C.
点评 本题考查电解原理,侧重于电解水型的考查,题目难度不大,注意阴阳离子的放电顺序,把握电解特点和规律.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的氢化物溶液与其最高价氧化物对应的水化物溶液的酸碱性相反 | |
| B. | Y的氧化物既可与强酸反应又可与强碱反应,并可用来制作耐火材料 | |
| C. | X和Z的最高价氧化物对应的水化物的浓溶液都是具有强氧化性的酸 | |
| D. | 因为Z的氢化物相对分子质量大于X的氢化物,其熔沸点较高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气不能使干燥的有色布条褪色,液氯能使干燥的有色布条褪色 | |
| B. | 实验室制取氯气时,常用饱和石灰水来吸收多余的氯气 | |
| C. | 漂白粉中含有次氯酸,所以漂白粉能使染料有机色素褪色 | |
| D. | 氯气可用于自来水消毒,因其反应产生次氯酸能杀死细菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2 | B. | Cu2(OH)2SO4 | C. | 3Cu(OH)2•CuSO4 | D. | Cu(OH)2•3CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是第Ⅷ族元素 | |
| B. | 它是第六周期元素 | |
| C. | 它属于过渡元素 | |
| D. | 它的某种同位素核内中子数大于质子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
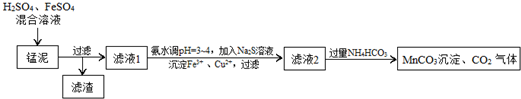
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com