
中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
(1)有效减碳的手段之一是节能,下列制氢方法最节能的是 。
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O CO+3H2
CO+3H2
(2)CO2可转化成有机物实现碳循环。在体积为1 L 的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
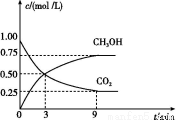
①从3 min到9 min,v(H2)= mol/(L·min)。
②能说明上述反应达到平衡状态的是 (填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g) CH3OH(g)的平衡常数:
CH3OH(g)的平衡常数:
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×1 | 2.4×1 | 1×1 |
下列说法正确的是 。
A.该反应正反应是放热反应
B.该反应在升高温度时,CH3OH(g)的体积分数减小,说明v正(CH3OH)减小,v逆(CH3OH)增大
C.在T ℃时,1 L密闭容器中,投入0.1 mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5 Mpa)和250 ℃,是因为此条件下,原料气转化率最高
(1)C(3分) (2)①0.125(2分) ②D(3分)
(3)AC(4分)
【解析】(1)电解和高温都需要消耗大量能源,太阳光催化分解水制氢最节能。(2)①根据图像可知,从3 min到9 min内CO2减少了0.25 mol/L,所以H2减少了0.75 mol/L,故v(H2)=0.125mol/(L·min)。②在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,故D对;平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,故A错;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,故B错;选项C中反应速率的方向是相同的,由于速率之比是相应的化学计量数之比,因此C中的关系始终成立,不正确。(3)根据表中数据可知,随着温度的升高,K值是逐渐减小的,这说明升高温度,平衡向逆反应方向移动,因此正反应是放热反应,选项A正确;升高温度,v正(CH3OH)和v逆(CH3OH)均增大,选项B不正确;平衡时CO、氢气、甲醇的浓度分别是(mol/L)0.05、0.1、0.05,所以平衡常数K=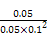 =100,选项C正确;由于正反应是放热的,因此升高温度不利于反应物的转化,故D错,答案选AC。
=100,选项C正确;由于正反应是放热的,因此升高温度不利于反应物的转化,故D错,答案选AC。


科目:高中化学 来源:2014高考化学苏教版总复习 专题13化学与技术练习卷(解析版) 题型:选择题
下列有关铁、铝的冶炼的说法中,正确的是( )
A.冶金工业中,金属铁的冶炼主要采用电解法
B.炼铁过程中铁的氧化物被焦炭还原生成单质铁,电解冶炼铝的过程中,阳极生成铝单质,阴极生成氧气
C.炼铁的主要原料是铁矿石、焦炭、生石灰和空气,电解冶炼铝的原料是氧化铝和冰晶石
D.铁、铝冶炼设备分别是炼铁高炉和铝电解槽
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题11有机化学基础练习卷(解析版) 题型:选择题
某有机物的结构简式如下图所示(未表示出其空间构型)。下列关于该物质的性质描述不正确的是( )
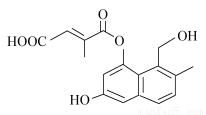
A.能使酸性KMnO4溶液褪色
B.能与FeCl3溶液发生显色反应
C.既能发生消去反应,也能发生取代反应
D.1 mol该物质最多可与5 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题10化学实验基础练习卷(解析版) 题型:选择题
为达到预期的实验目的,下列操作正确的是( )
①配制FeCl3溶液时,将FeCl3固体溶于盐酸中,然后再加蒸馏水稀释到所需的浓度 ②用10 mL量筒量取4.80 mL的浓硫酸 ③蒸发溶液时,边加热边搅拌,直至蒸发皿中的液体蒸干 ④向无色溶液中加BaCl2溶液,生成白色沉淀,再加稀硝酸,沉淀不消失,由此确定该溶液中一定含有SO42— ⑤为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量 ⑥中和热测定的实验中使用的玻璃仪器只有2种 ⑦实验室可利用浓氨水和碱石灰混合的方法制取少量氨气 ⑧除NO中混有的NO2气体可通过水洗,再干燥后用向上排空气法收集 ( )
A.③⑤⑧ B.④⑤⑥ C.①⑤⑦ D.①⑦⑧
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题10化学实验基础练习卷(解析版) 题型:选择题
在下列实验中,不能达到目的的是( )
A.Fe与Cl2反应生成FeCl3,Fe与S反应生成FeS,确定非金属性:Cl>S
B.用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合溶液,确定铜和镁的金属活动性强弱
C.进行H2O和H2S的热分解实验,确定硫和氧两种元素的非金属性强弱
D.用pH试纸测定氯水的酸碱性
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师高考模拟演练练习卷(B)(解析版) 题型:选择题
下列有关方程式书写正确的是( )
A.NaHCO3的电离:NaHCO3 Na++H++C
Na++H++C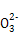
B.HS-的水解:HS-+H2O H3O++S2-
H3O++S2-
C.氢氧燃料电池在碱性介质中的负极反应式:O2+2H2O+4e- 4OH-
4OH-
D.用饱和Na2CO3溶液处理重晶石:BaSO4+C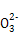
 BaCO3+S
BaCO3+S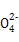
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师高考模拟演练练习卷(A)(解析版) 题型:填空题
2013年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成雾霾天气的原因之一。
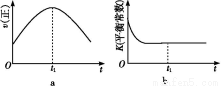
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g)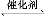 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
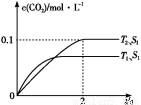
据此判断:
①该反应是 反应(填“放热”或“吸热”)。
②在T2温度下,0~2 s内的平均反应速率v(N2)= 。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
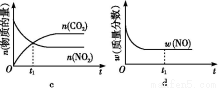
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)ΔH=-867 kJ/mol
N2(g)+CO2(g)+2H2O(g)ΔH=-867 kJ/mol
2NO2(g) N2O4(g) ΔH=-56.9 kJ/mol
N2O4(g) ΔH=-56.9 kJ/mol
写出CH4(g)催化还原N2O4(g)生成N2(g)和H2O(g)的热化学方程式: 。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为 。
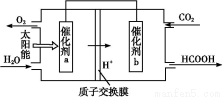
③常温下,0.1 mol/L的HCOONa溶液pH为10,则HCOO-平衡常数Kh= 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 离子反应练习卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A.Na2O2与H2O反应:2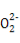 +2H2O
+2H2O 4OH-+O2↑
4OH-+O2↑
B.FeCl2溶液与稀硝酸反应:Fe2++N +4H+
+4H+ Fe3++NO↑+2H2O
Fe3++NO↑+2H2O
C.CaCO3与醋酸溶液反应:CaCO3+2H+ Ca2++CO2↑+H2O
Ca2++CO2↑+H2O
D.KAl(SO4)2溶液与氨水反应:Al3++3NH3·H2O Al(OH)3↓+3N
Al(OH)3↓+3N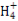
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 化学反应中的能量变化练习卷(解析版) 题型:选择题
上海世博会中国馆、主题馆等建筑使用光伏并网发电,总功率达4兆瓦,是历届世博会之最。已知发出白光的LED是由氮化镓GaN芯片与钇铝石榴石(YAG,化学式:Y3Al5O12)芯片封装在一起做成的。下列有关叙述正确的是( )

A.光伏电池实现了太阳能和电能的相互转化
B.图中N型半导体为正极,P型半导体为负极
C.电流从a流向b
D.LED中的Ga和Y都显+3价
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com