
【题目】氢气是一种理想的绿色能源。
(1)在101KP下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题:
①氢气的燃烧热为______________;
②该反应的热化学方程式为________________________________;
(2)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)===MgH2(s) ΔH1=-74.5kJ·mol-1;
Mg2Ni(s)+2H2(g)===Mg2NiH4(s) ΔH2;
Mg2Ni(s)+2MgH2(s)===2Mg(s)+Mg2NiH4(s) ΔH3=+84.6kJ·mol-1。
则ΔH2=____________kJ·mol-1;
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
(3)倒入NaOH溶液的正确操作是_______________(从下列选出)。
A.沿玻璃棒缓慢倒入 B.一次迅速倒入 C.分三次少量倒入
(4)使硫酸与NaOH溶液混合均匀的正确操作是_________(从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒搅拌棒轻轻地搅动
(5)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ______ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H=______________(取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是:___________。(任意写出一点)
【答案】 285.8 kJ·mol-1 2H2(g)+ O2(g)= 2H2O(l) ΔH=-571.6kJ·mol-1 -64.4kJ·mol-1 B D 4.0 -53.5kJ/mol 实验装置保温、隔热效果差;分多次把NaOH溶液倒入盛有硫酸的小烧杯中 ;用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度等
【解析】(1)①实验测得,1g氢气燃烧生成液态水放出142.9kJ热量,1mol氢气2g完全反应生成液态水放热为285.5kJ,则氢气的燃烧热285.5kJ/mol,故答案为:285.5kJ/mol;
②则表示氢气燃烧的热化学方程式为:H2(g)+ ![]() O2(g)=H2O(l)△H=-285.8KJ/mol或2H2(g)+ O2(g)= 2H2O(l) ΔH=-571.6kJ/mol,故答案为: H2(g)+
O2(g)=H2O(l)△H=-285.8KJ/mol或2H2(g)+ O2(g)= 2H2O(l) ΔH=-571.6kJ/mol,故答案为: H2(g)+ ![]() O2(g)=H2O(l)△H=-285.8KJ/mol或2H2(g)+ O2(g)= 2H2O(l) ΔH=-571.6kJ/mol;
O2(g)=H2O(l)△H=-285.8KJ/mol或2H2(g)+ O2(g)= 2H2O(l) ΔH=-571.6kJ/mol;
(2)①Mg(s)+H2(g)═MgH2(s)△H1=-74.5kJmol-1,②Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)ΔH3=+84.6kJ·mol-1。由盖斯定律2×①+②得到Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=(-74.5KJ/mol)×2+(84.6KJ/mol)=-64.4KJ/mol,则△H2=-64.4KJ/mol,故答案为:-64.4;
(3)为了减小实验误差,倒入NaOH溶液需要一次迅速倒入,故选B;
(4)使硫酸与NaOH溶液混合均匀的正确操作是用套在温度计上的环形玻璃棒搅拌棒轻轻地搅动,故选D;
(5)①4次温度差分别为:4.0℃,6.1℃,3.9℃,4.1℃,第2数据舍去,其他三次温度差平均值=![]() =4.0℃,故答案为:4.0;
=4.0℃,故答案为:4.0;
②50mL0.50mol/L氢氧化钠与30mL0.50mol/L硫酸溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80ml×1g/ml=80g,温度变化的值为△T=4℃,则生成0.025mol水放出的热量为Q=mc△T=80g×4.18J/(g℃)×4.0℃=1337.6J,即1.3376KJ,所以实验测得的中和热△H=-![]() =-53.5 kJ/mol,即稀强酸、稀强碱反应生成1mol液态水时放出53.5kJ热量,故答案为:-53.5kJ/mol;
=-53.5 kJ/mol,即稀强酸、稀强碱反应生成1mol液态水时放出53.5kJ热量,故答案为:-53.5kJ/mol;
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能有:装置保温、隔热效果差,测得的热量偏小,中和热数值偏小; NaOH溶液未完全倒入反应,则参加反应的NaOH偏小,测得的热量偏小,中和热数值偏小;分多次把NaOH溶液倒入盛有硫酸的小烧杯中,散失的热量多,测得的热量偏小,中和热数值偏小等,故答案为:实验装置保温、隔热效果差;分多次把NaOH溶液倒入盛有硫酸的小烧杯中等(任意写出一点)。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】FeCO3与砂糖混用可作补血剂。以黄铁矿烧渣(含CuO、Fe2O3、FeO、SiO2、Al2O3等)为主要原料制备FeCO3的流程如下:

(1)质量分数为30%(密度是1.176 g·cm-3)的稀硫酸的物质的量浓度为________。
(2)检验滤液A中存在Fe2+的试剂是________。
(3)加入足量铁粉的作用除调节pH使Al3+转化为Al(OH)3沉淀外,还有两个作用,分别写出这两个反应的离子方程式:____________ , ________________。
(4)写出滤液C与NH4HCO3溶液反应的离子方程式:_____________________。
(5)FeCO3在空气中灼烧可制得铁系氧化物材料。已知25 ℃,101 kPa时:
4Fe(s)+3O2(g)![]() 2Fe2O3(s)ΔH=-1 648 kJ·mol-1
2Fe2O3(s)ΔH=-1 648 kJ·mol-1
C(s)+O2(g)![]() CO2(g)ΔH=-393 kJ·mol-1
CO2(g)ΔH=-393 kJ·mol-1
2Fe(s)+2C(s)+3O2(g)![]() 2FeCO3(s)ΔH=-1 480 kJ·mol-1
2FeCO3(s)ΔH=-1 480 kJ·mol-1
写出FeCO3在空气中灼烧生成Fe2O3的热化学方程式:________。
(6)某兴趣小组为充分利用副产品,欲利用滤渣D为原料制取Al2O3,请补充完成实验步骤:向滤渣D中加入适量________溶液,_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—种微生物燃枓电池如图所示,下列关于该电池说法正确的是:

A. a电极为正极
B. H+由右室通过质子交换膜进入左室
C. a电极反应式为:C6H5OH-28e-+11H2O=6CO2↑+28H+
D. 当b电极上产生lmolN2时,溶液中将有l0mole-通过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
对甲苯丙烯酸甲酯 (E)是一种用于合成抗血栓药的中间体,其合成路线如下:
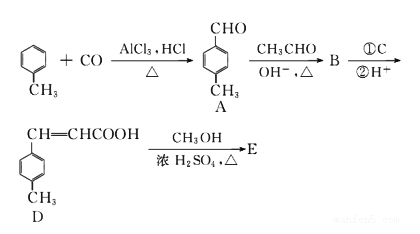
已知:HCHO+CH3CHO![]() CH2=CHCHO+H2O
CH2=CHCHO+H2O
(1)A中官能团的名称为_______,A分子中核磁共振氢谱各峰值比为________。
(2)物质B的结构简式为_______,生成E的反应类型为__________。
(3)试剂C可选用下列中的_________。
a.溴水 b.银氨溶液 c.酸性KMnO4溶液 d.新制Cu(OH)2悬浊液
(4)![]() 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为__________________。
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为__________________。
(5)遇FeCl 3溶液显紫色,且苯环上有两个取代基的A的同分异构体有______种,E在一定条件下可以生成高聚物F,F的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式 。
(2)写出NaClO3发生反应的主要离子方程式 ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式 。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为 。
(4)“操作1”中包含3个基本实验操作,它们依次是 、 和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是 。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是 ;其使用的最佳pH范围是 。

A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 。(答一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述正确的是
①CS2为V形的极性分子②ClO3-的立体构型为平面三角形
③SF6中有6对完全相同的成键电子对④SiF4和SO32-的中心原子均采用sp3杂化
A.①③B.②④C.①②D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作,预测的实验现象和实验结论或解释正确的是
实验操作 | 预测的实验现象 | 实验结论或解释 | |
A | 向饱和Na2CO3 溶液中滴加少量稀盐酸 | 立即有气体逸出 | CO32-+2H+=H2O+CO2↑ |
B | 将浓硫酸滴加到盛有铜片的试管中,并将蘸有品红溶液的试纸置于试管口 | 品红试纸褪色 | SO2具有漂白性 |
C | 铝箔在酒精灯火焰上加热 | 铝熔化但不会滴下 | A12O3的熔点比铝高 |
D | 向淀粉的酸性水解液中滴入少量新制 Cu (OH)2悬浊液并加热 | 有砖红色沉淀生成 | 葡萄糖具有还原性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容下,有反应2A(g)+2B(g)![]() C(g)+3D(g),现从两条途径分别建立平衡。途径Ⅰ:A、B的起始浓度均为2mol·L-1;途径Ⅱ:C、D的起始浓度分别为2mol·L-1和6mol·L-1。以下叙述正确的是( )
C(g)+3D(g),现从两条途径分别建立平衡。途径Ⅰ:A、B的起始浓度均为2mol·L-1;途径Ⅱ:C、D的起始浓度分别为2mol·L-1和6mol·L-1。以下叙述正确的是( )
A. 达到平衡时,途径Ⅰ的反应速率等于途径Ⅱ的反应速率
B. 达到平衡时,途径Ⅰ所得混合气体的压强等于途径Ⅱ所得混合气体的压强
C. 两途径最终达到平衡时,体系内各组分的百分含量相同
D. 两途径最终达到平衡时,体系内各组分的百分含量不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是
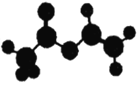
A. 该化合物的名称为乙酸乙酯
B. 该化合物的链状同分异构体中,能与NaHCO3反应放出CO2的只有3种
C. 该化合物既能发生水解反应.又能发生缩聚反应
D. 该化合物与Br2的四氯化碳溶液不反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com