
【题目】FeCO3与砂糖混用可作补血剂。以黄铁矿烧渣(含CuO、Fe2O3、FeO、SiO2、Al2O3等)为主要原料制备FeCO3的流程如下:

(1)质量分数为30%(密度是1.176 g·cm-3)的稀硫酸的物质的量浓度为________。
(2)检验滤液A中存在Fe2+的试剂是________。
(3)加入足量铁粉的作用除调节pH使Al3+转化为Al(OH)3沉淀外,还有两个作用,分别写出这两个反应的离子方程式:____________ , ________________。
(4)写出滤液C与NH4HCO3溶液反应的离子方程式:_____________________。
(5)FeCO3在空气中灼烧可制得铁系氧化物材料。已知25 ℃,101 kPa时:
4Fe(s)+3O2(g)![]() 2Fe2O3(s)ΔH=-1 648 kJ·mol-1
2Fe2O3(s)ΔH=-1 648 kJ·mol-1
C(s)+O2(g)![]() CO2(g)ΔH=-393 kJ·mol-1
CO2(g)ΔH=-393 kJ·mol-1
2Fe(s)+2C(s)+3O2(g)![]() 2FeCO3(s)ΔH=-1 480 kJ·mol-1
2FeCO3(s)ΔH=-1 480 kJ·mol-1
写出FeCO3在空气中灼烧生成Fe2O3的热化学方程式:________。
(6)某兴趣小组为充分利用副产品,欲利用滤渣D为原料制取Al2O3,请补充完成实验步骤:向滤渣D中加入适量________溶液,_______________________________。
【答案】 3.6 mol·L-1 酸性KMnO4溶液 Fe+2Fe3+![]() 3Fe2+ Fe+Cu2+
3Fe2+ Fe+Cu2+![]() Fe2++Cu Fe2++2HCO3--
Fe2++Cu Fe2++2HCO3--![]() FeCO3↓+CO2↑+H2O 4FeCO3(s)+O2(g)
FeCO3↓+CO2↑+H2O 4FeCO3(s)+O2(g)![]() 2Fe2O3(s)+4CO2(g)ΔH=-260 kJ·mol-1 NaOH 过滤,向滤液中通入足量CO2,过滤并洗涤沉淀,加热所得沉淀至恒重,即可得氧化铝
2Fe2O3(s)+4CO2(g)ΔH=-260 kJ·mol-1 NaOH 过滤,向滤液中通入足量CO2,过滤并洗涤沉淀,加热所得沉淀至恒重,即可得氧化铝
【解析】(1)考查物质的量浓度的计算,c=1000ρw%/M=1000×1.176×30%/98mol·L-1=3.6mol·L-1;(2)本题考查离子的检验,滤液A中含有的离子是H+、Al3+、Fe3+、Fe2+、Cu2+、SO42-,检验Fe2+,可以利用Fe2+的还原性,即加入KMnO4溶液、溴水等,如果溶液颜色褪去,说明溶液中含有Fe2+,也可以用铁氰化钾溶液,出现蓝色沉淀,说明存在Fe2+;(3)考查铁及其化合物的性质,滤液A中含有离子是H+、Al3+、Fe3+、Fe2+、Cu2+、SO42-,加入铁单质,发生的离子方程式为Fe+2Fe3+=3Fe2+、Fe+Cu2+=Cu+Fe2+;(4)根据流程,加入NH4HCO3溶液后,得到FeCO3,离子反应方程式为Fe2++2HCO3-- FeCO3↓+CO2↑+H2O ;(5)考查热化学反应方程式的计算,FeCO3与氧气的反应是4FeCO3+O2=2Fe2O3+4CO2↑,①4Fe(s)+3O2(g) =2Fe2O3(s),②C(s)+O2(g)= CO2(g),③2Fe(s)+2C(s)+3O2(g)=2FeCO3,根据盖斯定律,①+②×4-③×2,得到:△H=(-1648-393×4+1480×2)kJ·mol-1=-260kJ·mol-1,即热化学反应方程式为4FeCO3(s)+O2(g) =2Fe2O3(s)+4CO2(g)ΔH=-260 kJ·mol-1;(6) 考查物质的制备, 根据问题(3),滤渣D含有成分是Fe、Cu、Al(OH)3,利用氢氧化铝的两性,加入适量的NaOH,然后过滤,向滤液中通入足量CO2,过滤并洗涤沉淀,加热所得沉淀至恒重,即可得氧化铝。


科目:高中化学 来源: 题型:
【题目】在反应S+KOH→K2SO3+K2S2+H2O(未配平)中,被氧化与被还原的硫原子个数比为
A. 1∶4 B. 4∶1 C. 1∶2 D. 2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
①NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点FeO________NiO(填“<”或“>”);
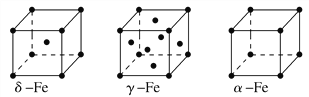
②铁有δ、γ、α三种同素异形体,各晶胞如下图,则δ、α两种晶胞中铁原子的配位数之比为________。
(2)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为________;该晶体中,原子之间的强相互作用是________。
(3)某钙钛型复合氧化物如图1所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。
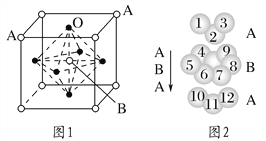
①用A、B、O表示这类特殊晶体的化学式:_________________________。
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为________。
③下列有关说法正确的是________。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图2所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.元素的第一电离能越大,其金属性一定越强
B.元素的第一电离能越小,其金属性一定越强
C.同主族元素的单质从上到下,金属性增强,熔点升高
D.金属单质与酸反应越容易,其元素的电负性越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不引入新杂质的情况下,分离FeCl3、KCl、BaSO4的混合物,应选用的一组试剂是
A. 水、氢氧化钾溶液、稀盐酸 B. 水、氢氧化钠溶液、稀盐酸
C. 水、硝酸银溶液、稀硝酸 D. 水、氢氧化钾溶液、稀硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 在NH![]() 和[Cu(NH3)4]2+中都存在配位键
和[Cu(NH3)4]2+中都存在配位键
B. HF、HCl、HBr、HI的熔、沸点依次升高
C. CO2、SO2都是极性分子
D. 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种元素分别是元素周期表中三个连续短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子的最外层电子数之和。Y与X形成的分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z两种元素的元素符号为:X________、Z________。
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为________,它的共价键属于________(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为__________;含有极性共价键和非极性共价键的化合物的结构式为_________。
(3)由X、Y、Z所形成的常见离子化合物是________(写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为_______________________________。
X与W形成的化合物与水反应时,水作________(填“氧化剂”或“还原剂”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用NaOH固体配制245 mL 1.2 mol/L的NaOH溶液,填空并请回答下列问题:
(1)配制245 mL 1.2 mol/L的NaOH溶液,需用托盘天平称取NaOH______g,所需的玻璃仪器有量筒、烧杯、______________________________________。
(2)容量瓶上需标有以下五项中的_____________________。(填序号)
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)在定容操作时,应将蒸馏水注入容量瓶,液面离容量瓶颈刻度线______________处,改用____________滴加蒸馏水至与刻度线相平。盖好瓶塞,反复颠倒摇匀。
(4)本实验中,下列配制的溶液浓度偏低的是_____________。 (填字母代号)
A.称量NaOH时,使用游码,砝码错放在左盘
B.向容量瓶中转移溶液时,不慎有液滴洒在容量瓶外面
C.定容时仰视观察液面
D.溶解后未冷却到室温就将溶液转移到容量瓶中
E.配制前,容量瓶中有少量蒸馏水
(5)下列关于容量瓶的使用方法和操作的描述,正确的是___________。(填字母代号)
A.使用容量瓶前检查它是否漏水
B.引流时,玻璃棒的下端应在容量瓶刻度线以上
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,定容至刻度线
D.配制溶液时,若试样是液体,用量筒取试样后直接倒入容量瓶中,缓慢加水定容至刻度线
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种理想的绿色能源。
(1)在101KP下,1g氢气完全燃烧生成液态水放出142.9kJ的热量,请回答下列问题:
①氢气的燃烧热为______________;
②该反应的热化学方程式为________________________________;
(2)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)===MgH2(s) ΔH1=-74.5kJ·mol-1;
Mg2Ni(s)+2H2(g)===Mg2NiH4(s) ΔH2;
Mg2Ni(s)+2MgH2(s)===2Mg(s)+Mg2NiH4(s) ΔH3=+84.6kJ·mol-1。
则ΔH2=____________kJ·mol-1;
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
(3)倒入NaOH溶液的正确操作是_______________(从下列选出)。
A.沿玻璃棒缓慢倒入 B.一次迅速倒入 C.分三次少量倒入
(4)使硫酸与NaOH溶液混合均匀的正确操作是_________(从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒搅拌棒轻轻地搅动
(5)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ______ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H=______________(取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是:___________。(任意写出一点)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com