
【题目】我国科技创新成果斐然,下列成果中获得诺贝尔奖的是( )
A.徐光宪建立稀土串级萃取理论
B.屠呦呦发现抗疟新药青蒿素
C.闵恩泽研发重油裂解催化剂
D.侯德榜创立联合制碱法
科目:高中化学 来源: 题型:
【题目】下列说法正确的是:( )
①Cl-的结构示意图
②羟基的电子式:![]()
③HClO的结构式:H—Cl—O
④NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-
⑤Na2O的水溶液能导电,这不能说明Na2O是电解质
⑥SiO2既能与氢氟酸反应又能与NaOH溶液反应,故SiO2是两性氧化物;
⑦分馏、干馏、裂化都是化学变化( )
A.①②⑤ B.①④⑥⑦ C.②③④⑥ D.②③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示三个烧瓶中分别装入含酚酞的0.01 mol/LCH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质.
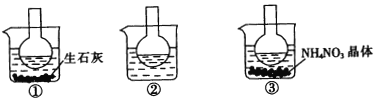
(1)含酚酞的0.01 mol/L CH3COONa溶液显浅红色,其原因为____________________.
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是___________.
A.水解反应为放热 反应 B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量 D.NH4NO3溶于水时吸收热量
(3)向三份0.01 mol L—1的CH3COONa溶液中分别加入少量浓盐酸、NaOH固体、Na2CO3固体,则CH3COO-的水解平衡分别________、_________、_________。(填向“左移动”“向右移动”或“不移动”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是常规核裂变产物之一,可以通过测定大气或水中
是常规核裂变产物之一,可以通过测定大气或水中![]() 的含量变化来监测核电站是否发生放射性物质泄漏。下列有关
的含量变化来监测核电站是否发生放射性物质泄漏。下列有关![]() 的叙述中错误的是
的叙述中错误的是
A. ![]() 的化学性质与
的化学性质与![]() 相同 B.
相同 B. ![]() 的原子序数为53
的原子序数为53
C. ![]() 的原子核外电子数为78 D.
的原子核外电子数为78 D. ![]() 的原子核内中子数多于质子数
的原子核内中子数多于质子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3-+H2O![]() H2SO3+OH- ①
H2SO3+OH- ①
HSO3-![]() H++SO32- ②
H++SO32- ②
向 0.1 mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )
A.加入少量金属 Na,平衡①左移,平衡②右移,溶液中 c(HSO3-)增大
B.加入少量NaOH溶液,![]() 、
、![]() 的值均增大
的值均增大
C.加入少量Na2SO3 固体,则 c(H+)+c(Na+)=c(HSO3-)+c(OH-)+![]() c(SO32-)
c(SO32-)
D.加入氨水至中性,则 2c(Na+)=c(SO32-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知反应 2HI(g)![]() H2(g)+I2(g)的 ΔH=+11kJ/mol, 1mol H2(g)、 1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为_________kJ。
H2(g)+I2(g)的 ΔH=+11kJ/mol, 1mol H2(g)、 1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为_________kJ。
(2)Bodensteins 研究了下列反应:2HI(g) ![]() H2(g)+I2(g)在 716 K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如下表:
H2(g)+I2(g)在 716 K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为__________。
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为__________(以K和k正表示)。若 k正=0.0027 min-1,在 t=40min 时,v正=_________ min-1。
③由上述实验数据计算得到v正~x(HI)和 v逆~x(H2)的关系如图所示。当升高到某一温度时,反应重新达到平衡,相应的点依次为__________(填字母)和__________(填字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定平衡常数对定量认识化学反应具有重要意义。已知:I2能与 I-反应生成 I3-,并在溶液中建立如下平衡: I2+I-![]() I3-。通过测平衡体系中 c(I2)、 c(I-)和 c(I3-),就可求得该反应的平衡常数。
I3-。通过测平衡体系中 c(I2)、 c(I-)和 c(I3-),就可求得该反应的平衡常数。
Ⅰ.某同学为测定上述平衡体系中 c(I2),采用如下方法:取 V1 mL 平衡混合溶液,用cmol·L-1的Na2S2O3溶液进行滴定(反应为 I2+2Na2S2O3=2NaI+Na2S4O6),消耗 V2 mL 的Na2S2O3溶液。根据V1、V2和c可求得c(I2)。
(1)上述滴定时,可采用________做指示剂,滴定终点的现象是_____________________。
(2)下列对该同学设计方案的分析,正确的是________(填字母)。
A.方案可行。能准确测定溶液中的 c(I2)
B.不可行。因为 I-能与 Na2S2O3发生反应
C.不可行。只能测得溶液中 c(I2)与 c(I3-)之和
Ⅱ.化学兴趣小组对上述方案进行改进,拟采用下述方法来测定该反应的平衡常数(室温条件下进行,溶液体积变化忽略不计):

已知: ①I-和 I3-不溶于 CCl4; ②一定温度下, 碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即![]() 是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
(3)操作Ⅰ使用的玻璃仪器中,除烧杯、玻璃棒外,还需要的仪器是________(填名称)。试指出该操作中应注意的事项为________。 (任写一条)
(4)上述测定过程均正常操作,下层液体中碘单质的物质的量浓度是________;若终点读数时俯视滴定管, 则会造成所测浓度________ (填“等于”、 “大于”或“小于”)该值。
(5)实验测得上层溶液中 c(I3-)=0.0049 mol·L-1,结合上述有关数据,计算室温条件下反应 I2+I-![]() I3-的平衡常数 K=________(用具体数据列出计算式即可)。
I3-的平衡常数 K=________(用具体数据列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废气中的H2S通过高温热分解可制取氢气:2H2S(g)![]() 2H2(g)+ S2(g)(正反应吸热)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
2H2(g)+ S2(g)(正反应吸热)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
(1)某温度时,测得反应体系中有气体1.31 mol,反应10 min后,测得气体为l.37 mol,则10 min 内H2的平均生成速率为________________。
(2)某温度时,判断H2S的转化率达到最大值的依据是________(选填编号)。
a.气体的压强不发生变化 b.气体的密度不发生变化
c.单位时间里分解的H2S和生成的H2一样多 d.反应物不再转化为生成物
(3)如图所示,该可逆反应在t0时因改变某外界条件而打破原平衡,在t1时达到新的平衡状态,因此推断,t0时改变的外界条件可能是__________________、___________________。

(4)在容器体积不变的情况下,如果要提高H2S的转化率,可采取的一种措施是_____________。
(5)在实验室,若将H2S通入浓硫酸中,发生的化学反应的方程式是:__________。
(6)若将H2S完全燃烧后,并用碳酸钠与碳酸氢钠的混合溶液吸收生成气体SO2,发生如下反应:2Na2CO3+SO2+H2O→ 2NaHCO3+Na2SO3
充分反应后(无CO2逸出),所得溶液组成如表:
物质 | Na2CO3 | NaHCO3 | Na2SO3 |
物质的量(mol) | 2 | 12 | 4 |
则原吸收液中碳酸钠与碳酸氢钠的物质的量之比________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com