
【题目】已知X、Y元素同周期,且电负性![]() ,下列说法错误的是
,下列说法错误的是
A.X与Y形成化合物是,X可以显负价,Y显正价
B.第一电离能可能Y大于X
C.当它们均为非金属时,气态氢化物的稳定性:X大于Y
D.当它们均为非金属时,最高价含氧酸的酸性:X小于Y
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=lgc(Ba2+),p(SO42)=lgc(SO42)。下列说法正确的是
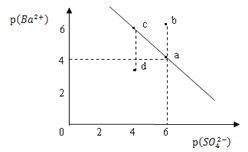
A. 该温度下,Ksp(BaSO4)=1.0×1024
B. 加入BaCl2可以使溶液由c点变到a点
C. d点表示的是该温度下BaSO4的不饱和溶液
D. a点的Ksp(BaSO4)小于b点的Ksp(BaSO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是工农业生产中不可或缺的物质,研究制取氨气的机理意义非凡。
(1)在常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面与水发生下列反应:
N2(g)+3H2O(l)![]() 2NH3(g)+3/2O2(g) △H= a kJ mol-1。
2NH3(g)+3/2O2(g) △H= a kJ mol-1。
为进一步研究生成NH3的物质的量与温度的关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
n(NH3)/(l0-2mol) | 4.8 | 5.9 | 6.0 |
此反应的a_________0,△S________0。(填“>”“<”或“ = ”)
(2)—定温度和压强下,在2 L的恒容密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) △H="-92.4" kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
2NH3(g) △H="-92.4" kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
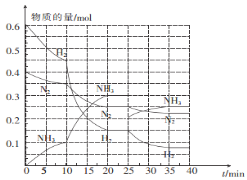
①0~10 min内,以NH3表示的平均反应速率为_________。
②在10~20 min内,NH3浓度变化的原因可能是_______。
A.加入催化剂 B.缩小容器体积 C.降低温度 D.增加NH3的物质的量
③ 20 min达到第一次平衡,在反应进行至25 min时,曲线发生变化的原因是____________,35min达到第二次平衡,则平衡的平衡常数K1______K2(填“>”“<”或“ = ”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图装置完成表中的四个实验,不能达到实验目的的是
实验装置 | 实验目的 | 试剂X | 试剂Y | |
| A. | 检验C2H5Br消去反应后的气体产物 | 水 | 酸性KMnO4溶液 |
B. | 检验C2H5OH消去反应后的气体产物 | NaOH溶液 | Br2的CCl4溶液 | |
C. | 比较醋酸、碳酸、苯酚酸性强弱 | NaOH溶液 | 苯酚钠溶液 | |
D. | 检验制取乙炔时的气体产物 | CuSO4溶液 | 酸性KMnO4溶液 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂(LiIFePO4)电池(如图所示)是新能源汽车的动力电池之一。M电极是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池的总反应为LixC6+Li1-xFePO4![]() LiFePO4+6C。下列说法正确的是
LiFePO4+6C。下列说法正确的是
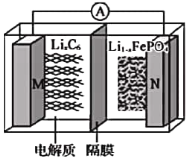
A. 放电时,Li+向M电极移动
B. 充电时电路中每通过0.5mol电子,就有36g碳和金属锂复合在一起
C. 放电时,M电极的电极反应为![]()
D. 充电时,N电极的电极反应为LiFePO4-xe-=xLi++Li1-xFePO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有六种元素,其中A、B、C、D、E为短周期主族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 |
B元素原子的核外p电子数比s电子数少1 |
C元素基态原子p轨道有两个未成对电子 |
D原子的第一至第四电离能分别是: Ⅰ |
E原子核外所有p轨道全满或半满 |
F在周期表的第8纵列 |
(1)某同学根据上述信息,推断A基态原子的核外最子排布为了![]() ,该同学所画的电子排布图违背了___________。
,该同学所画的电子排布图违背了___________。
(2)![]() 元素的电负性_____
元素的电负性_____![]() 填“大于”、“小于”或“等于”
填“大于”、“小于”或“等于”![]() 元素的电负性。
元素的电负性。
(3)![]() 基态原子中能量最高的电子,其电子云在空间有__________个方向。
基态原子中能量最高的电子,其电子云在空间有__________个方向。
(4)下列关于F原子的价层电子排布图正确的是___________。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(5)基态![]() 离子核外电子排布式为_____________。
离子核外电子排布式为_____________。
(6)元素铜与镍的第二电离能分别为:![]() ,
,![]() ,
,![]() 原因是_________。
原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。继续失去第二个电子所需能量称第二电离能。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。回答下列问题:
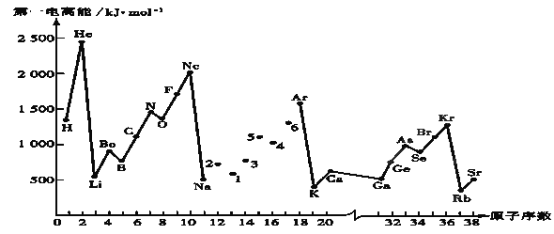
(1)同一周期元素的第一电离能从左到右总趋势是___(填增大、减小或不变,下同);同一主族元素原子从上到下的第一电离能I1变化规律是______________;稀有气体的第一电离能在同周期中是最大的,原因是______________________________________________________________________。
(2)认真分析上图中同周期元素第一电离能的变化规律,发现有一些反常,第一电离能 IIA>IIIA,VA>VIA: 如I1(铍)>I1(硼),2号大于1号,I1(氮)>I1(氧),5号大于4号。可能原因是____。(3)已知2号的I1=738KJ/mol, 则它的I2___738KJ/mol, I3___3×738KJ/mol;(填>、<、=)(4)已知5号和6号元素的电负性分别为2.1和3.0,则4号元素的电负性可能为(___)
A.3.5 | B.1.8 | C.2.5 | D.4.0 |
(5)上图中4、5、6三种元素最高价含氧酸的酸性从强到弱顺序为____________(用对应酸的化学式表示);它们的气态氢化物的稳定性均比同主族上一周期的元素气态氢化物弱,原因是:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO3溶液显酸性,溶液中存在以下平衡:
![]() + H2O
+ H2O![]() H2SO3 + OH- ①
H2SO3 + OH- ①
![]()
![]() H+ +
H+ + ![]() ②
②
向0.1mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是
A.加入少量金属Na,平衡①左移,平衡②右移,溶液中c(![]() )增大
)增大
B.加入少量Na2SO3固体,则c(H+) + c(Na+) = c(![]() ) + c(OH-) +
) + c(OH-) +![]() c(
c(![]() )
)
C.加入少量NaOH溶液, 、
、 的值均增大
的值均增大
D.加入氨水至中性,则2c(Na+) = c(![]() )>c(H+) = c(OH-)
)>c(H+) = c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定环境中能大量共存的是( )
A.在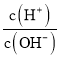 =1013的溶液中:NH4+、Ca2+、Cl-、K+
=1013的溶液中:NH4+、Ca2+、Cl-、K+
B.由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、HCO3-、Cl-、K+
C.无色溶液中可能大量存在Al3+、NH4+、Cl-、S2-
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com