
【题目】已知NaHSO3溶液显酸性,溶液中存在以下平衡:
![]() + H2O
+ H2O![]() H2SO3 + OH- ①
H2SO3 + OH- ①
![]()
![]() H+ +
H+ + ![]() ②
②
向0.1mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是
A.加入少量金属Na,平衡①左移,平衡②右移,溶液中c(![]() )增大
)增大
B.加入少量Na2SO3固体,则c(H+) + c(Na+) = c(![]() ) + c(OH-) +
) + c(OH-) +![]() c(
c(![]() )
)
C.加入少量NaOH溶液, 、
、 的值均增大
的值均增大
D.加入氨水至中性,则2c(Na+) = c(![]() )>c(H+) = c(OH-)
)>c(H+) = c(OH-)
科目:高中化学 来源: 题型:
【题目】在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)![]() 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是

A. 图中a点的值为0.15 B. 该反应的平衡常数K=0.03
C. 温度升高,平衡常数K值减小 D. 平衡时A2的转化率为62.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y元素同周期,且电负性![]() ,下列说法错误的是
,下列说法错误的是
A.X与Y形成化合物是,X可以显负价,Y显正价
B.第一电离能可能Y大于X
C.当它们均为非金属时,气态氢化物的稳定性:X大于Y
D.当它们均为非金属时,最高价含氧酸的酸性:X小于Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)![]() MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2既是温室气体,也是重要的化工原料,二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入足量的活性炭和一定量的NO,发生反应C(s)+ 2NO(g) ![]() N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
浓度/(mol/L)/\时间/min | 0 | 10 | 20 | 30 | 40 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
①根据图表数据分析T1℃时,该反应在0~10min内的平均反应速率v(N2)=____________mol·L-1·min-1;计算该反应的平衡常数K=_____________。
②若30min后只改变某一条件,据上表中的数据判断改变的条件可能是____________(填字母编号)。
A.加入合适的催化剂 B.适当缩小容器的体积
C.通入一定量的NO D.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率___________(填“升高”或“降低”),△H______0(填“>”或“<”)。
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式_______________。
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:_________________________。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10 的溶液,则溶液中c(CO32-)∶c(HCO3-)=_______________。[常温下K1(H2CO3
②欲用2LNa2CO3溶液将4.66gBaSO4 固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为__________________________。[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10]。(忽略溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法正确的是
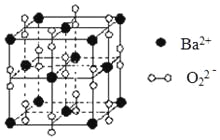
A.与每个Ba2+距离相等且最近的Ba2+共有6个
B.晶体中Ba2+的配位数为8
C.晶体的化学式为Ba2O2
D.该氧化物是含有非极性键的离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应为NiO2+ Fe+2H2O![]() Fe(OH)2+Ni(OH)2。下列有关该电池的说法中正确的是
Fe(OH)2+Ni(OH)2。下列有关该电池的说法中正确的是
A.放电时电解质溶液显强酸性
B.充电时阳板反应为Ni(OH)2+2OH--2e-=NiO2+2H2O
C.放电时正极附近溶液pH减小
D.充电时阴极附近溶液的碱性保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用石油热裂解的副产物中的甲烷来制取氢气,需要分两步进行,其反应过程中的能量变化如图所示:
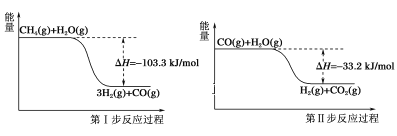
则甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为( )
A.CH4(g)+H2O(g)=3H2(g)+CO(g) ΔH=-103.3kJ/mol
B.CH4(g)+2H2O(g)=4H2(g)+CO2(g) ΔH=-70.1kJ/mol
C.CH4(g)+2H2O(g)=4H2(g)+CO2(g) ΔH=70.1kJ/mol
D.CH4(g)+2H2O(g)=4H2(g)+CO2(g) ΔH=-136.5kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com