
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=lgc(Ba2+),p(SO42)=lgc(SO42)。下列说法正确的是
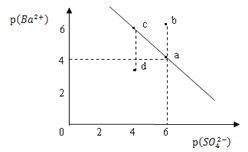
A. 该温度下,Ksp(BaSO4)=1.0×1024
B. 加入BaCl2可以使溶液由c点变到a点
C. d点表示的是该温度下BaSO4的不饱和溶液
D. a点的Ksp(BaSO4)小于b点的Ksp(BaSO4)
【答案】B
【解析】
根据已知:p(Ba2+)=lgc(Ba2+),p(SO42)=lgc(SO42)可以得出沉淀溶解平衡线随着横坐标增大,硫酸根离子浓度逐渐减小,钡离子浓度增大;a、c达到了沉淀溶解平衡,d属于过饱和溶液,b属于未饱和溶液。
A.a点钡离子浓度和硫酸根离子浓度分别为1.0×10-4和1.0×10-6,所以Ksp(BaSO4)=1.0×10-10,故A错误;
B. c加入BaCl2可以使溶液钡离子浓度增大,硫酸根离子浓度减小,由c点变到a点,故B正确;
C.p(Ba2+)的值越大,钡离子浓度越小,所以d点是过饱和溶液,故C错误;
D.图中的是平衡曲线,线上的任意点都是平衡状态,所以a、b点Ksp相同,a点的Ksp(BaSO4)等于b点的Ksp(BaSO4),故D错误;


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】在工业生产上中,主要用Na2SO3制造亚硫酸纤维素酯、硫代硫酸钠、有机化学药品、漂白织物等。但Na2SO3在空气中易氧化为Na2SO4而变质。为了求出变质样品中Na2SO3的含量,采用0.2 mol·L-1KMnO4酸性溶液滴定用样品配制的溶液。反应离子方程式是:2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O,称取20 g样品,配成250 mL溶液,量取25 mL进行滴定,记录数据,再重复2次实验。
填空完成问题:
(1)滴定实验不需要下列仪器中的________。
A.酸式滴定管(50 mL) B.碱式滴定管(50 mL) C.量筒(10 mL) D.锥形瓶 E.铁架台 F.滴定管夹
G.白纸 H.玻璃棒
(2)已知滴定过程不需要指示剂,理由是_______________________。
(3)下列操作中可能使所测Na2SO3溶液的浓度数值偏低的是________(填字母)。
A.盛放Na2SO3溶液的滴定管没有使用Na2SO3溶液润洗
B.锥形瓶内有水残留,没有烘干,装入待测的Na2SO3溶液滴定
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
(4)滴定完毕,三次实验平均消耗0.2 mol·L-1KMnO4酸性溶液20.00mL,则样品中Na2SO3的百分含量为:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() ,
,![]() 。某温度下,AgBr、AgCl在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
。某温度下,AgBr、AgCl在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
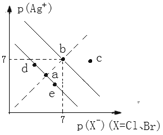
A. ![]()
![]()
B.向饱和AgCl溶液中加入NaCl固体,可使a点变到d点
C.一定温度下,AgCl固体分别在下列溶液a.![]() 、溶液b.
、溶液b.![]() 蒸馏水、c.
蒸馏水、c.![]() 溶液中的溶解度由大到小的排列顺序是b>a>c
溶液中的溶解度由大到小的排列顺序是b>a>c
D.常温下,AgCl在纯水中的![]() 比在
比在![]() 溶液中的
溶液中的![]() 大
大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各离子方程式中,属于水解反应且书写正确的是( )
A.CH3COO-+NH4++H2O===CH3COOH+NH3·H2O
B.CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
C.HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
D.Al3++3HCO3-===Al(OH)3↓+3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(化学式用H2B表示)在水中的电离方程式是H2B===H++HB-;HB-![]() H++B2-在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是( )
H++B2-在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是( )
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中,可逆反应: H2(g) + I2(g) ![]() 2HI (g)达到平衡的标志是
2HI (g)达到平衡的标志是
A. H2、I2、HI的分子数之比为1∶1∶2
B. 混合气体的密度保持不变
C. 单位时间生成n mol H2,同时消耗2n mol HI
D. 混合气体的颜色不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
①C2H2(g)+![]() O2(g)
O2(g)![]() 2CO2(g)+H2O(l) ΔH1=-1 301.0 kJ·mol-1
2CO2(g)+H2O(l) ΔH1=-1 301.0 kJ·mol-1
②C(s)+O2(g)![]() CO2(g) ΔH2=-393.5 kJ·mol-1
CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH3=-285.8 kJ·mol-1
H2O(l) ΔH3=-285.8 kJ·mol-1
则反应④2C(s)+H2(g)![]() C2H2(g)的ΔH为( )
C2H2(g)的ΔH为( )
A. -228.2 kJ·mol-1B. +228.2 kJ·mol-1
C. +1301.0 kJ·mol-1D. +621.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)![]() 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是

A. 图中a点的值为0.15 B. 该反应的平衡常数K=0.03
C. 温度升高,平衡常数K值减小 D. 平衡时A2的转化率为62.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y元素同周期,且电负性![]() ,下列说法错误的是
,下列说法错误的是
A.X与Y形成化合物是,X可以显负价,Y显正价
B.第一电离能可能Y大于X
C.当它们均为非金属时,气态氢化物的稳定性:X大于Y
D.当它们均为非金属时,最高价含氧酸的酸性:X小于Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com