
【题目】(1)用系统命名法给下列有机物命名:
CH3CH2C(CH3)2CH2CH3_________________________________________
化合物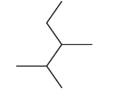 按系统命名法命名__________________________
按系统命名法命名__________________________
2,3-二甲基-4-乙基-2-庚烯的结构简式__________________________
(2)分子式为C4H8O2能发生水解反应的同分异构体有_____种,甲苯的一氯代物有______种。
(3)从某些植物树叶提取的挥发油中含有下列主要成分
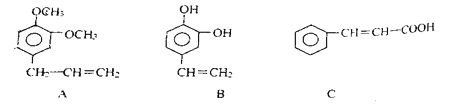
A的分子式是___________,B中的含氧官能团是____________。
【答案】3,3-二甲基戊烷 2,3-二甲基戊烷 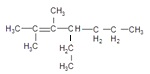 四 四 C11H14O2 酚羟基
四 四 C11H14O2 酚羟基
【解析】
(1)最长的碳链为主链含有5个碳原子,称为戊烷,从靠近支链的一端开始编号,要求支链的位次和最小,因此两个支链的位置为3、3,故命名为3,3-二甲基戊烷。最长的碳链为主链含有5个碳原子,称为戊烷,两个支链的位置为2、3,故命名为2,3-二甲基戊烷。2,3-二甲基-4-乙基-2-庚烯是主链上有7个碳原子,且2、3号碳原子上取代甲基,4号碳原子上取代乙基,并且2、3号碳原子之间含有C=C,故结构简式为: 故答案为:3,3-二甲基戊烷,2,3-二甲基戊烷,
故答案为:3,3-二甲基戊烷,2,3-二甲基戊烷, ;
;
(2)因为分子式为C4H8O2可发生水解,所以它一定是酯类。同分异构体有四种,1. HCOOCH2CH2CH3 甲酸丙酯2. HCOOCH(CH3)CH3 甲酸异丙酯3. CH3COOCH2CH3 乙酸乙酯4, CH3CH2COOCH3 丙酸甲酯,甲苯的一氯代物可在甲基上取代1种和苯环上取代3种,故共有四种,故答案为:四,四;
(3)由A的结构简式可知分子式为C11H14O2,B中的含氧官能团是酚羟基,故答案为:C11H14O2,酚羟基。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】氮的化合物是重要的工业原料,也是主要的大气污染来源,研究氮的化合物的反应具有重要意义。回答下列问题:
(1)肼(N2H4)与四氧化二氮分别是火箭发射器中最常用的燃料与氧化剂。已知3.2g液态肼与足量液态四氧化二氮完全反应,生成氮气和液态水放出热量61. 25 kJ,则该反应的热化学方程式为____。
(2)尾气中的NO2可以用烧碱溶液吸收的方法来处理,其中能生成NaNO2等物质,该反应的离子方程式为____。
(3)在773 K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中发生反应生成NH3,气体混合物中c(N2)、c(H2)、c(NH3)与反应时间(t)的关系如图所示。
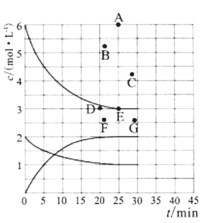
①下列能说明反应达到平衡状态的是____(选填字母)。
a.v正(N2)=3v逆(H2) b.体系压强不变
c.气体平均相对分子质量不变 d.气体密度不变
②在此温度下,若起始充入4. 00 mol N2和12. 00 mol H2,则反应刚达到平衡时,表示 c(H2)~t的曲线上相应的点为 ___(选填字母)。
(4)在373 K时,向体积为2L的恒容真空容器中充入0.40mol NO2,发生如下反应:![]()
测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①计算0~20min时,v(N2O4)=____。
②已知该反应![]() ,其中k1、k2为速率常数,则373K时,
,其中k1、k2为速率常数,则373K时,![]() =_____;改变温度至T1时,k1=k2,则T1___ 373 K(填“>”“<”或“=”)。
=_____;改变温度至T1时,k1=k2,则T1___ 373 K(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性:![]() >HCO3—,现要将
>HCO3—,现要将![]() 转变为
转变为![]() ,可行的方法是
,可行的方法是
①与足量的NaOH溶液共热,再通入足量的CO2气体
②与稀H2SO4共热后,再加入足量的NaOH溶液
③加热该物质的溶液,再通入足量的SO2气体
④与稀H2SO4共热后,再加入足量的NaHCO3溶液
A. ①②B. ②③C. ③④D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水淡化的方法有蒸馏法、________________________(填1种方法)。
(2)海水中制得的饱和氯化钠溶液可以利用电解法直接制取次氯酸钠,制取的离子方程式为____。
(3)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):

将Br2与Na2CO3反应的化学方程式补充完整:
___Br2+___Na2CO3===___NaBrO3+___ ________+___ ________
(4)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):

已知:常温下0.010 mol·L-1金属离子在不同pH下的沉淀情况如下:
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是_____________。
②NaClO还能除去盐卤中的CO(NH2)2,生成盐和一种能参与大气循环的物质。除去0.2 mol CO(NH2)2时消耗NaClO ________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是

A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气中主要污染物SO2、NOx,为消除排放,保护环境,实现绿色可持续发展。
处理方法一:烟气经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NO的主要反应的热化学方程式为:
NO(g)+O3(g)=NO2(g)+O2(g) △H1
NO(g)+1/2O2(g)=NO2(g) △H2
SO2(g)+O3(g)![]() SO3(g)+O2(g) △H3
SO3(g)+O2(g) △H3
(1)反应3NO(g)+O3(g)=3NO2(g)的△H=_________。
(2) 室温下,进入反应器的NO、SO2的物质的量恒定,改 变通入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):nNO)的变化见图。说明预处理过程中NO2的物质的量变化的原因_______,在反应中SO2的物质的量几乎不发生变化的原因是_______________。

(3)在一定条件下,SO2(g)+O3(g)![]() SO3(g)+O2(g) △H3<0,在一定温度下,向2L某恒容密闭容器中充入4molSO2(g)和1molO3(g),5min时,测得容器中SO3(g)的物质的量为0.5mol。
SO3(g)+O2(g) △H3<0,在一定温度下,向2L某恒容密闭容器中充入4molSO2(g)和1molO3(g),5min时,测得容器中SO3(g)的物质的量为0.5mol。
①0-5min内,用SO2表示的平均反应速率v(SO2)________。
②下列说法中能判断该反应达到平衡状态的是________
a.单位时间内生成nmolSO2同时生成nmolSO3
b.SO3和O2的物质的量浓度之比1:1
C.容器内压强保持不变
d.混合气体的密度不变
e.混合气体的平均相对分子质量不变
处理方法二: 也可采用NaClO2溶液作为吸收剂对烟气进行处理。在不同温度下,NaClO2溶液脱硫(S)、脱硝(N)的反应中,SO2和NO的平衡分压Pe如图所示。

(4) 由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均_______(填“增大”、“不变”或“减小”)。
(5) 反应ClO2-+2SO32-![]() 2SO42-+Cl-的平衡常数K表达式为_______。
2SO42-+Cl-的平衡常数K表达式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第23号元素钒在地壳中的含量大约为0.009%,在过渡元素中仅次于Fe、Ti、Mn、Zn,排第五位。我国四川攀枝花地区蕴藏着极其丰富的钒钛磁铁矿。
(1)钒在周期表中的位置为__________,电子占据的最高能层的轨道形状为__________。
(2)在地壳中含量最高的五种过渡金属元素Fe、Ti、Mn、Zn、V中,基态原子核外单电子数最多的是__________。
(3)过渡金属可形成许多羰基配合物,即CO作为配体形成的配合物。
①CO的等电子体有N2、CN-、__________(任写一个)等。
②CO作配体时,配位原子是C而不是O,其原因是__________。
(4)过渡金属配合物常满足“18电子规则”,即中心原子的价电子数加上配体提供的电子数之和等于18,如[Fe(CO)5]、[Mn(CO)5]-等都满足这个规则。
①下列钒配合物中,钒原子满足18电子规则的是__________。
A.[V(H2O)6]2+ B.[V(CN)6]4- C.[V(CO)6]- D.[V(O2)4]3-
②化合物 的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“
的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“![]() ”中的大π键可表示为__________。
”中的大π键可表示为__________。
(5)VCl2(熔点1027 ℃)和VBr2(熔点827 ℃)均为六方晶胞,结构如图所示。

①VCl2和VBr2两者熔点差异的原因是__________。
②设晶体中阴、阳离子半径分别为r-和r+,该晶体的空间利用率为__________(用含a、c、r+和r-的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度t1和t2下,卤素单质X2(g)和H2反应生成HX的化学平衡常数如下表,仅根据下表数据不能判断的是( )
化学方程式 | K(t1) | K(t2) |
F2+H2 | 1.8×1036 | 1.9×1032 |
Cl2+ H2 | 9.7×1012 | 4.2×1011 |
Br2+H2 | 5.6×107 | 9.3×106 |
I2+H2 | 43 | 34 |
A.已知t2>t1,HX的生成反应为放热反应
B.在相同条件下, X2平衡转化率:F2>Cl2
C.X2的活泼性随原子序数递增逐渐减弱
D.2F2+2H2![]() 4HF K(t1)=3.6×1036
4HF K(t1)=3.6×1036
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 31 g白磷(![]() )含有共价键的总数为1.5NA
)含有共价键的总数为1.5NA
B. 常温下,22.4 mL H2O中所含氢氧键的数目约为2.49NA
C. 8.7 g MnO2与40 mL 10 mol·L-1的浓盐酸充分反应,生成的氯气分子数为0.1NA
D. 常温下,1 L pH=11的Na2CO3溶液中由水电离出的H+数目为0.001NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com