
高中化学实验中常见的使用温度计有如下3种情形①温度计的液泡浸没在液体反应物液面以下;②温度计的液泡置于水浴中;③温度计的液泡置于蒸馏烧瓶的支管口处。下列实验使用温度及正确的是……( )
A、苯的硝化反应---① B、酒精和浓硫酸混合加热制乙烯---①
C、测定硝酸钾在水中的溶解度---③ D、分离苯和硝基苯的混合物---②
科目:高中化学 来源: 题型:阅读理解
| c(H2)c(CO) |
| c(H2O) |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
 和
和 .实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式
.实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
高中化学实验中常见的使用温度计有如下3种情形
①温度计的液泡浸没在液体反应物液面以下 ②温度计的液泡置于水浴中 ③温度计的液泡置于蒸馏烧瓶的支管口处。
下列实验使用温度及正确的是
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
铜有Cu2O(红色)和CuO(黑色)两种常见的氧化物。某高中化学兴趣小组的同学对初中课本实验的结论“H2与CuO反应生成红色物质Cu”提出质疑,认为生成的红色物质不一定就是铜。为了确定该红色物质的成分,该兴趣小组开展了以下研究。
(一)提出猜想:红色物质可能是铜、氧化亚铜或两者的混合物。
(二)查阅资料:①Cu2+在酸性条件下能发生自身氧化还原反应(Cu2O+2H+ =Cu2++Cu+H2O);②在空气中灼烧Cu2O能生成CuO。
(三)制备红色物质:方法同初中课本
(四)红色物质成分的探究:
甲同学设计了以下三种探究方案:
方案I:取该红色物质溶于足量稀硝酸中,观察溶液颜色的变化。
方案II:取该红色物质溶于足量稀硫酸中,观察现象。
方案III:称得干燥的坩埚的质量为m1g,取红色物质置于坩埚中再称得质量为m2g。
然后将红色物质在空气中充分灼烧至完全变黑,并在干燥器中冷却,再称量,反复多次直到质量不变,称得最后质量为m3g,比较m1、m2、m3。
回答下列问题:
(1)方案I是否合理 (填“合理”或“不合理”)。如果你认为该方案合理,请简述其工作原理;如果你认为该方案不合理,请简述原因。 。
(2)方案II中,若观察不到明显现象,则可知红色物质为 ;若观察到溶液变为蓝色,则可知红色物质为 。
(3)方案III中,如果m1、m2、m3的关系符合m3= ,可确认红色物质为Cu2O。
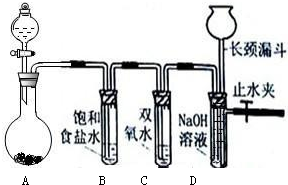
(4)乙同学利用下列装置设计了第四种探究方案:

各装置接口的正确连接顺序是( )接( )( )接( )( )接( );试剂X可选用 ;要测定红色物质的成分,最少需要测定的物理量是 (填序号)。
①通入氢气的体积 ②反应前,红色物质+反应管的总质量
③实验前干燥管的质量 ④完全反应后,红色物质+反应管的总质量
⑤反应管的质量 ⑥实验后干燥管的质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com