
【题目】(1)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为______________。又已知:H2O(g)=H2O(l);△H2=-44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ。
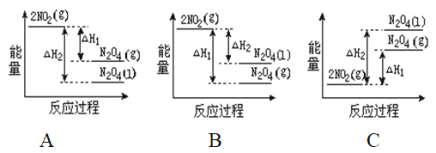
(2)已知:2NO2(g)![]() N2O4(g)ΔH1 2NO2(g)
N2O4(g)ΔH1 2NO2(g)![]() N2O4(l)ΔH2
N2O4(l)ΔH2
下列能量变化示意图中,正确的是(选填字母)_____________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2 599 kJ·mol-1
根据盖斯定律,计算298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的焓变(列出简单的计算式):___________________________。
(4)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体(结构简式为CH3OH)。 已知某些化学键的键能数据如下表:
化学键 | C—C | C—H | H—H | C—O | C≡O | H—O |
键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为_________。
【答案】B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) △H=-2165kJ/mol 1016.5kJ A ΔH=(4ΔH1+ΔH2—ΔH3)÷2=+226.7kJmol-1 CO(g)+2H2(g)![]() CH3OH(g) △H=-116 kJ/mol
CH3OH(g) △H=-116 kJ/mol
【解析】
(1)0.3mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出2165kJ的热量,反应的热化学方程式为:B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-2165kJ/mol;①B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-2165kJ/mol,②H2O(l)→H2O(g) △H=+44kJ/moL,由盖斯定律可知①+②×3得:B2H6(g)+3O2(g)=B2O3(s)+3H2O(g)△H=-2033kJ/mol,11.2L(标准状况)即0.5mol乙硼烷完全燃烧生成气态水时放出的热量是2033kJ/mol×0.5mol=1016.5kJ;
(2)降低温度,将NO2(g)转化为N2O4(l)说明反应2NO2(g)![]() N2O4(l)为放热反应,所以在图象中该反应的反应物的总能量比生成物的总能量高,同种物质气态变液态会放出热量,即液态时能量比气态时能量低,则N2O4(l)具有的能量比N2O4(g)具有的能量低,图象A符合,故A正确;故答案为:A。
N2O4(l)为放热反应,所以在图象中该反应的反应物的总能量比生成物的总能量高,同种物质气态变液态会放出热量,即液态时能量比气态时能量低,则N2O4(l)具有的能量比N2O4(g)具有的能量低,图象A符合,故A正确;故答案为:A。
(3)已知:①C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1;②2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol-1;③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2 599 kJ·mol-1,根据盖斯定律,①×4+②-③得到反应的热化学方程式为:4C(s,石墨)+2H2(g)=2C2H2(g) △H=+453.4kJmol-1,因此热化学方程式为:2C(s,石墨)+H2(g)=C2H2(g) △H=+226.7kJmol-1;
(4)CO(g)+2H2(g)![]() CH3OH(g),焓变=反应物总键能之和-生成物总键能之和,△H1=1072kJ/mol+2×436kJ/mol-(3×413kJ/mol+358kJ/mol+463kJ/mol)=-116
CH3OH(g),焓变=反应物总键能之和-生成物总键能之和,△H1=1072kJ/mol+2×436kJ/mol-(3×413kJ/mol+358kJ/mol+463kJ/mol)=-116 ![]() CH3OH(g)△H=-116 kJmol-1。
CH3OH(g)△H=-116 kJmol-1。


科目:高中化学 来源: 题型:
【题目】合成氨工业生产中所用的αFe催化剂的主要成为FeO、Fe2O3。
(1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比4∶5,其中Fe2+与Fe3+物质的量之比为_____。
(2)当催化剂中Fe2+与Fe3+的物质的量之比为1∶2时,其催化剂活性最高,此时混合物中铁的质量分数为______(保留2位小数)。
(3)写出由C(炭粉)与Fe2O3在高温下反应制备α铁触媒的化学方程式(另一种产物可溶于水)_____。
(4)为制得这种活性最高的催化剂,理论上应向480 g Fe2O3粉末加入炭粉的质量为_____,生成实验条件下CO2的体积为_____(假设此实验条件下,气体摩尔体积为24 L·mol-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中各微粒浓度关系不正确的是( )
A.pH相等的①CH3COONa②C6H5ONa③NaHCO3溶液中,c(Na+)大小关系:①>③>②
B.向氨水中滴加稀硫酸至溶液呈中性:c(NH4+)>c(SO42-)>c(OH-)=c(H+)
C.向1L 0.1mol/L的NaOH溶液中通入6.6gCO2:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.CH3COONa溶液中加入少量KNO3后的碱性溶液一定有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z族序数之和为10;Y的原子半径在同周期主族元素中最小;W与Z形成的化合物常温下可与饱和NaCl溶液反应,产生的气体常用于切割和焊接金属。下列说法错误的是( )
A.X的单质是人类将太阳能转化为电能的常用材料
B.Y元素可以形成多种含氧酸
C.X元素在自然界中只有化合态没有游离态
D.W与Z形成的化合物与饱和NaCl溶液的反应产生的气体分子中只含极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成溴苯的装置图及有关数据如下,按下列合成步骤回答:


(1)实验装置中,仪器c的名称为________________,作用为_______________。
(2)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白雾产生,是因为生成了_______气体。继续滴加至液溴滴完。写出a中发生反应的化学方程式:_________________________________________。
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是____________________________________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入无水氯化钙的目的是_______________。
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为____________,要进一步提纯,需进行的操作方法为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备高纯硅有多种方法,其中的一种工艺流程如下:
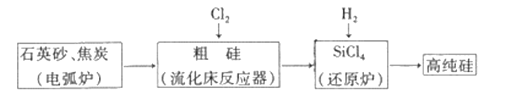
已知:流化床反应的产物中,除SiCl4外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3等。下列说法正确的是
A. 电弧炉中发生的反应为C+SiO2![]() CO2↑+Si
CO2↑+Si
B. SiCl4进入还原炉之前需要经过蒸馏提纯
C. 每生产l mol高纯硅,需要44. 8L Cl2(标准状况)
D. 该工艺Si的产率高,符合绿色化学要求
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质从左至右按同类有机物、同位素、同系物、同分异构体、同素异形体、同种物质的顺序排列的是( )
①C60、C70、金刚石、石墨 ②苯甲醇、对甲基苯酚、邻甲基苯酚、间甲基苯酚
③![]() 、
、![]() 、
、![]() ④HOCH2CHO、HOCH2CH2CHO、HOCH2CH2CH2CHO
④HOCH2CHO、HOCH2CH2CHO、HOCH2CH2CH2CHO
⑤新戊烷、2,2二甲基丙烷 ⑥甲醇、乙二醇、丙三醇
A.①⑥②③⑤④B.⑥③⑤④①②
C.④②⑥①⑤③D.⑥③④②①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学实验的叙述正确的是( )
A.配制1molL-1的硫酸铜溶液200mL,需要称取胆矾晶体40g
B.蒸馏实验中,冷凝管中冷却水应从下口通入,从上口放出
C.欲除去Fe粉中混有的I2,可加热使I2升华
D.检验溶液中是否含有Fe2+的方法是:向溶液中滴加KSCN溶液无明显现象,再向溶液中加入适量双氧水发现有血红色沉淀生成,则说明原溶液中存在Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Fe、Fe2O3和CuO的混合粉末加入到100mL 4.4mol/L 的盐酸中,充分反应后,充分反应后,生成标准状况下的氢气896mL。过滤,滤渣经洗涤、干燥后称量,质量为1.28g。滤液中的溶质只有FeCl2和HCl,滤液加水稀释到320mL时,盐酸的浓度为0.25mol/L。
请回答:
(1)反应生成氢气的物质的量为_______ mol;
(2)计算原混合物中铁单质的质量(写出计算过程)。________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com