
【题目】我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,直到近年来人们才研究出来其成分为BaCuSi4O10,BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均具有Cun+离子,n=___,基态时该阳离子的价电子排布式为______。
(2)在5500年前,古代埃及人就己经知道如何合成蓝色颜料—“埃及蓝”CaCuSi4O10,其合成原料中用CaCO3代替了BaCO3,其它和“中国蓝”一致。CO32一中键角∠OCO为___。根据所学,从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更___(填“高”或“低”)。
(3)配离子Cu(CN)32-中,中心离子的杂化类型是___________,该配离子的空间构型为___________;CN-中配位原子是___________ (填名称)。
(4)CaCux合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列而成。(a)是由Cu和Ca共同组成的层,层中Cu—Cu之间由实线相连;(b)是完全由Cu原子组成的层,Cu—Cu之间也由实线相连。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层的相对位置;(c)是由(a)和(b)两种原子层交替堆积成CaCux合金的晶体结构图。在这种结构中,同一层的Ca—Cu距离为294pm,相邻两层的Ca—Cu距离为327pm。
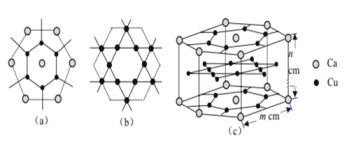
①该晶胞中Ca有___________个Cu原子配位(不一定要等距最近)。
②同一层中,Ca原子之间的最短距离是___________pm,设NA为阿伏加德罗常数的值,CaCu晶体的密度是___________g/cm3(用含m、n的式子表示)。
【答案】2 ![]()
![]() 低 sp2 平面三角形 碳 18
低 sp2 平面三角形 碳 18 ![]()
![]()
【解析】
(1)根据化学式BaCuSi4O10,BaCuSi2O6,其中Ba为+2价,Si为+4价,O为-2价,由化合价代数和为零得:“中国蓝”、“中国紫”中均具有Cun+离子,n=2,基态时该阳离子的价电子排布式为3d9。
故答案为:2;3d9;
(2)CO32一中心原子C的价电子为3+![]() =3,为平面三角形结构,键角∠OCO为120°。根据所学,钙离子半径小与氧之间的作用力大,碳酸钙更容易分解,故从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更低。
=3,为平面三角形结构,键角∠OCO为120°。根据所学,钙离子半径小与氧之间的作用力大,碳酸钙更容易分解,故从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更低。
故答案为:120°;低;
(3)配离子Cu(CN)32-中,中心离子的价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断中心原子的杂化方式为sp2,该配离子的空间构型为平面三角形;CN-中配位原子是碳,因为N元素电负性较大,不易提供孤电子对,
故答案为: sp2 ;平面三角形;碳;
(4)①以上面面心上的Ca原子为例,该晶胞中该Ca原子配位的Cu原子包含其上面6个、相同层6个、下层6个,所以其配位数是18,
故答案为:18;
②同一层中,六边形中心上的Ca原子和边上的两个Ca原子形成正三角形,所以Ca原子之间的最短距离是六边形边长=2×![]() ×(同层相邻Ca-Cu距离)=2×
×(同层相邻Ca-Cu距离)=2×![]() ×294pm=294
×294pm=294![]() pm;
pm;
该晶胞中Ca原子个数=12×![]() +2×
+2×![]() =3、Cu原子个数=12×
=3、Cu原子个数=12×![]() +6×
+6×![]() +6=15,该晶胞体积=(
+6=15,该晶胞体积=(![]() m2sin60°×6×n)cm3=
m2sin60°×6×n)cm3=![]() m2ncm3,晶体密度=
m2ncm3,晶体密度= =
=![]() g·cm-3,
g·cm-3,
故答案为:![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】化学与生活、生产密切相关,下列说法错误的是 ( )
A. Ge(32号元素)的单晶可以作为光电转换材料用于太阳能电池
B. 工业生产玻璃、水泥,均需要用石灰石为原料
C. 将二氧化硫添加于红酒中可以起到杀菌和抗氧化作用
D. 纳米铁粉和FeS都可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其原理是相同的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用浓硫酸和乙醇混合加热制取乙烯,下列说法正确的个数是( )

①浓硫酸只作催化剂
②在反应容器中放入几片碎瓷片防止混合液暴沸
③反应温度缓慢上升至 170℃
④用排水法或向下排气法收集乙烯
⑤圆底烧瓶中装的是 4mL 乙醇和 12mL 3mol/L H2SO4混合液
⑥温度计应插入反应溶液液面下,以便控制温度
⑦反应完毕后先熄灭酒精灯,再从水中取出导管
⑧该反应类型属于取代反应
⑨若 a 口出来的气体使酸性 KMnO4溶液褪色,说明有乙烯生成
A.1B.2C.3D.4 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2 L的密闭容器中,发生下列反应2A(g) + B(g) ![]() xC(g) + 2D(g),经4min后达平衡,测得D的浓度为1.0 mol·L-1,c(A) : c(B)=2 : 3,以C表示的平均速率υ(C)=0.125 mol·L-1·min-1,下列说法不正确的是
xC(g) + 2D(g),经4min后达平衡,测得D的浓度为1.0 mol·L-1,c(A) : c(B)=2 : 3,以C表示的平均速率υ(C)=0.125 mol·L-1·min-1,下列说法不正确的是
A. 反应速率υ(A)=0.25 mol·L-1·min-1
B. 该反应方程式中,x=1
C. 4 min时,B的物质的量为2 mol
D. 该反应的平衡常数K=1/3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知反应2HI(g)=H2(g) + I2(g)的△H=+11kJ·mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为___kJ。
(2)已知某密闭容器中存在下列平衡:CO(g)+H2O(g) ![]() CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。
CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。

①该反应△H__________ 0(填“>”或“<”)
②若T1、T2时的平衡常数分别为K1、K2,则K1_______K2(填“>”、“<”或“=”)。
③T3时在某刚性容器中按1:2投入CO(g)和H2O(g),达到平衡后测得CO的转化率为75%,则T3时平衡常数K3=____________。
(3)在恒容密闭容器中,加入足量的MoS2和O2,仅发生反应: 2MoS2(s)+7O2(g) ![]() 2MoO3(s)+4SO2(g) ΔH。
2MoO3(s)+4SO2(g) ΔH。
测得氧气的平衡转化率与起始压强、温度的关系如图所示:

①p1、p2、p3的大小:_________。
②若初始时通入7.0 mol O2,p2为7.0 kPa,则A点平衡常数Kp=________(用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,写出计算式即可)。
(4)中科院兰州化学物理研究所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。

催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
助剂 | CO2转化率(%) | 各产物在所有产物中的占比(%) | ||
C2H4 | C3H6 | 其他 | ||
Na | 42.5 | 35.9 | 39.6 | 24.5 |
K | 27.2 | 75.6 | 22.8 | 1.6 |
Cu | 9.8 | 80.7 | 12.5 | 6.8 |
①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加_______助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是_____;
②下列说法正确的是______;
a 第ⅰ步所反应为:CO2+H2![]() CO+H2O
CO+H2O
b 第ⅰ步反应的活化能低于第ⅱ步
c 催化剂助剂主要在低聚反应、异构化反应环节起作用
d Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯烃的ΔH减小
e 添加不同助剂后,反应的平衡常数各不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是

A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:_____ 。
(2)o、p两种元素的部分电离能数据如下表所示:
元素 | o | p | |
电离能/ |
| 717 | 763 |
| 1509 | 1561 | |
| 3248 | 2957 | |
比较两元素的![]() 、
、![]() 可知,气态
可知,气态![]() 再失去一个电子比气态
再失去一个电子比气态![]() 再失去一个电子难。对此,你的解释是 ___________。
再失去一个电子难。对此,你的解释是 ___________。
(3)表中所列的某主族元素的电离能情况如图所示,则该元素是上述元素中的____(填元素符号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。电解质溶液为KOH溶液,电池反应为:Cd +2NiO(OH)+2H2O![]() Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是
Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是
A. 充电过程是化学能转化为电能的过程
B. 充电时阳极反应为Cd(OH)2+2e—="=" Cd + 2OH-
C. 放电时电池内部OH - 向正极移动
D. 充电时与直流电源正极相连的电极上发生Ni(OH)2转化为NiO(OH)的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原子核外电子排布与元素在周期表中位置关系的叙述正确的是( )
A.基态原子核外N电子层上只有一个电子的元素一定是第ⅠA族元素
B.原子核外价电子排布式为![]() 的元素一定是副族元素
的元素一定是副族元素
C.基态原子的p能级上半充满的元素原子的价电子排布式为![]()
D.基态原子核外价电子排布式为![]() 的元素的族序数一定为x+y
的元素的族序数一定为x+y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com