
【题目】已知三种一元弱酸的酸性强弱 :HX>HY>HZ,则相同pH的NaX、NaY、NaZ溶液,其物质的量浓度由大到小的顺序正确的是
A.NaX、NaY、NaZ B.NaZ、NaY、NaX
C.NaY、NaZ、NaX D.NaX、NaZ、NaY
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
A.v(D)=0.4 moI/(L·s) B.v(C)=0.5 mol / (L·s)
C.v(B)=0.6 mol / (L·s) D.v(A)=0.15mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素可以形成多种化合物。回答下列问题:
(1)基态氮原子的价电子排布式是____;C、N、O 三种元素电负性从小到大的顺序是________。
(2)肼(N2H4)分子中氮原子轨道的杂化类型是______;肼可用作火箭燃料,燃烧时发生的反应时N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH=11038.7kJ·mol-1,若该反应中8molN-H键断裂,则形成的σ键有____mol;肼能与硫酸反应生成N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4晶体内不存在______(填字母)。
A.离子键 B.共价键 C.配位键 D.范德华力
(3)氨是________(填“极性”或“非极性”)分子;氨的沸点高于膦(PH3)的原因是________。
(4)将氨气通入硫酸铜水溶液中形成[Cu(NH3)4]SO4深蓝色溶液,[Cu(NH3)4]SO4中阴离子的立体构型是______。
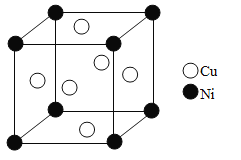
(5)单质铜和镍都是由金属键形成的晶体,元素铜和镍的第二电离能分别为:ICu=1959kJ·mol-1,INi=1753kJ·mol-1,ICu>INi的原因是_______。某镍白铜合金的立方晶胞结构如图所示。晶胞中镍原子与铜原子的个数比为_______。若合金的密度为dg/cm3,晶胞参数a=_________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的发展和环保要求不断提高,CO2的捕集利用技术成为研究的重点。
I.工业上使用的捕碳剂有NH3和(NH4)2CO3,它们与CO2可发生如下可逆反应:
NH3(l)+H2O(l)+CO2(g) ![]() NH4HCO3(aq) ΔH1
NH4HCO3(aq) ΔH1
2NH3(l)+H2O(l)+CO2(g) ![]() (NH4)2CO3(aq) ΔH2
(NH4)2CO3(aq) ΔH2
(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3 =______(用含ΔH1 、ΔH2 的代表式表示)。
II.目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的化学反应方程式为:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g),已知:H2的体积分数随温度的升高而增加。
CH4(g)+2H2O(g),已知:H2的体积分数随温度的升高而增加。
(1)该反应的ΔS_____0(填“>”、“=”、“<”),该反应的ΔH____0(填“>”、“<”)。
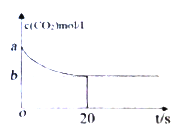
(2)在恒容密闭容器中通入等物质的量的CO2和H2并发生上述反应,温度T下,CO2物质的量浓度c(CO2)随时间t变化的曲线如下图所示。下列能说明反应达到平衡状态的是___。
A.体系压强保持不变
B.混合气体密度保持不变
C.甲烷和水蒸气的物质的量之比保持不变
D.H2的质量分数保持不变
(3)温度T下,反应前20秒的平均速率v(H2)= _________(用含a、b的代数式表示)。
(4)温度T下,该反应的平衡常数K=_________(用含a、b的代数式表示)。
(5)若降低温度,反应重新达到平衡,则v(正)_________;CO2转化率_________(填“增大”“减小”或“不变”)。
III.工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:

①在阳极区发生的反应包括_________和H++HCO3-=CO2↑+H2O。
②简述CO32-在阴极区再生的原理:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe2O3俗称氧化铁红,常用作油漆等着色剂。某实验小组用部分氧化的FeSO4为原料,以萃取剂X(甲基异丁基甲酮)萃取法制取高纯氧化铁并进行铁含量的测定。实验过程中的主要操作步骤如下:
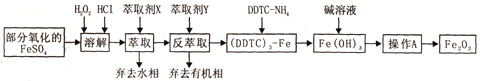
已知:①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮,当盐酸浓度降低时,该化合物解离。
② 3DDTC-NH4+Fe3+= (DDTC) 3-Fe↓+3NH4+
请回答下列问题:
(1)用萃取剂X萃取的步骤中,以下关于萃取分液操作的叙述中,正确的是____________。
A.FeSO4原料中含有的Ca2+、Cu2+等杂质离子几乎都在水相中
B.为提高萃取率和产品产量,实验时分多次萃取并合并萃取液
C.溶液中加入X,转移至分液漏斗中,塞上玻璃塞,如图用力振摇
D.振摇几次后需打开分液漏斗上口的玻璃塞放气
E.经几次振摇并放气后,手持分液漏斗静置待液体分层
F.分液时,将分液漏斗上的玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔,打开旋塞,待下层液体完全流尽时,关闭旋塞后再从上口倒出上层液体
(2)下列试剂中,可作反萃取的萃取剂Y最佳选择是_______________。
A.高纯水 B.盐酸 C.稀硫酸 D.酒精
(3)吸油量是反映氧化铁红表面性质的重要指标。吸油量大,说明氧化铁红表面积较大,则用在油漆中会造成油漆假稠,影响质量。不同浓度的两种碱溶液对产物吸油量影响如图所示,则上述实验过程中选用的碱溶液为_______________(填“NaOH”或“NH3·H2O”),反应的化学方程式为_________________。
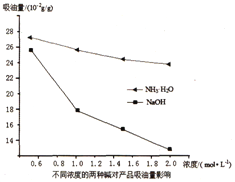
(4)操作A为______________________。
(5)现准确称取4.000g , 样品,经酸溶、还原为Fe2+,在容量瓶中配成100mL溶液,用移液管移取25.00 mL溶液于锥形瓶中,用0.l000mol/L的K2Cr2O7溶液进行滴定(还原产物是Cr3+),消耗K2Cr2O7溶液20.80mL。
① 用移液管从容量瓶中吸取25.00mL溶液后,把溶液转移到锥形瓶中的具体操作为_____。
② 产品中铁的含量为_______(假设杂质不与K2Cr2O7反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 足量Mg与2.8gN2完全反应后失去0.2NA电子
B. 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA
C. 常温常压下,2.8gC2H4含有共用电子对的数目为0.6NA
D. 16gO2含有NA个18O原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项说法正确的是( )
A. “84”消毒液的有效成分是NaClO
B. SO2具有漂白性,可用于加工食品,使食品增白
C. 可以用酒精萃取碘水中碘单质
D. SO2气体通入Ba(NO3)2溶液中不能产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:①CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是________________________________。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用标准状况下3.36 L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为____________mol,放出的热量为____________kJ(用含有a和b的代数式表示)。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH1=-574 kJ·mol-1①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867 kJ,则ΔH2=____________。
(4)某氮肥厂氨氮废水中的氮元素多以NH![]() 和NH3·H2O形式存在,该废水的处理流程中,NH
和NH3·H2O形式存在,该废水的处理流程中,NH![]() 在微生物作用的条件下经过两步反应被氧化成NO
在微生物作用的条件下经过两步反应被氧化成NO![]() 。两步反应的能量变化示意如图所示:
。两步反应的能量变化示意如图所示:
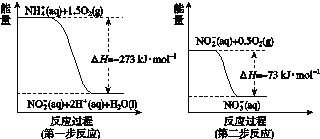
1 mol NH![]() (aq)全部氧化成NO
(aq)全部氧化成NO![]() (aq)的热化学方程式是________________。
(aq)的热化学方程式是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com