
【题目】Fe2O3俗称氧化铁红,常用作油漆等着色剂。某实验小组用部分氧化的FeSO4为原料,以萃取剂X(甲基异丁基甲酮)萃取法制取高纯氧化铁并进行铁含量的测定。实验过程中的主要操作步骤如下:
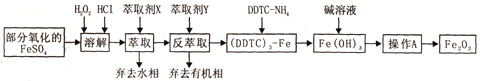
已知:①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮,当盐酸浓度降低时,该化合物解离。
② 3DDTC-NH4+Fe3+= (DDTC) 3-Fe↓+3NH4+
请回答下列问题:
(1)用萃取剂X萃取的步骤中,以下关于萃取分液操作的叙述中,正确的是____________。
A.FeSO4原料中含有的Ca2+、Cu2+等杂质离子几乎都在水相中
B.为提高萃取率和产品产量,实验时分多次萃取并合并萃取液
C.溶液中加入X,转移至分液漏斗中,塞上玻璃塞,如图用力振摇
D.振摇几次后需打开分液漏斗上口的玻璃塞放气
E.经几次振摇并放气后,手持分液漏斗静置待液体分层
F.分液时,将分液漏斗上的玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔,打开旋塞,待下层液体完全流尽时,关闭旋塞后再从上口倒出上层液体
(2)下列试剂中,可作反萃取的萃取剂Y最佳选择是_______________。
A.高纯水 B.盐酸 C.稀硫酸 D.酒精
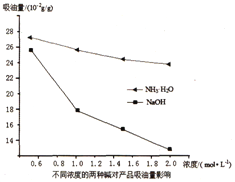
(3)吸油量是反映氧化铁红表面性质的重要指标。吸油量大,说明氧化铁红表面积较大,则用在油漆中会造成油漆假稠,影响质量。不同浓度的两种碱溶液对产物吸油量影响如图所示,则上述实验过程中选用的碱溶液为_______________(填“NaOH”或“NH3·H2O”),反应的化学方程式为_________________。
(4)操作A为______________________。
(5)现准确称取4.000g , 样品,经酸溶、还原为Fe2+,在容量瓶中配成100mL溶液,用移液管移取25.00 mL溶液于锥形瓶中,用0.l000mol/L的K2Cr2O7溶液进行滴定(还原产物是Cr3+),消耗K2Cr2O7溶液20.80mL。
① 用移液管从容量瓶中吸取25.00mL溶液后,把溶液转移到锥形瓶中的具体操作为_____。
② 产品中铁的含量为_______(假设杂质不与K2Cr2O7反应)。
【答案】 ABF A NAOH (DDTC)3-Fe+3NaOH=3DDTC-Na+Fe(OH)3↓ 过滤、洗涤、灼烧 将移液管垂直放入稍倾斜的锥形瓶中,使管尖与锥形瓶内壁接触,松开食指使溶液全部流出,数秒后,取出移液管。 69.89%
【解析】试题分析:本题以工艺流程图考查实验操作、图像分析、氧化还原反应滴定以及计算等。
(1)A项:由流程中的萃取操作可知,Ca2+、Cu2+等杂质离子几乎都在水相中弃去,正确;B项:实验时分多次萃取并合并萃取液可提高萃取率和产品产量,正确;C项:应右手手心顶住分液漏斗的塞子,并用右手握住漏斗颈部,用左手食指与中指夹住分液漏斗的旋塞,同时左手也握住分液漏斗,将分液漏斗倒置,振荡,错误;D项:振荡后,让分液漏斗仍保持倾斜状态(上口要倾斜朝下,而下口处不要有液体)旋开活塞,放出气体,使内外压力平衡,错误;E项:分层应该放置在铁架台上,错误;F项:分液时,将分液漏斗上的玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔,打开旋塞,待下层液体完全流尽时,关闭旋塞后再从上口倒出上层液体,正确。
(2) 根据信息在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮,当盐酸浓度降低时,该化合物解离。加高纯水时,酸度降低,所以用高纯水可以进行反萃取;
(3)据题中信息吸油量大,说明氧化铁红表面积较大,则用在油漆中会造成油漆假稠,影响质量,结合图2两条曲线可知:用NaOH溶液,获得的氧化铁表面积小,吸油量低;结合流程,(DDTC)3-Fe中加入碱液(NaOH)得到氢氧化铁沉淀,其反应为:(DDTC)3-Fe+3NaOH=3DDTC-Na+Fe(OH)3↓;
(4)需要Fe(OH)3沉淀从滤液中滤出并洗涤,然后灼烧即可得到三氧化二铁。故操作A为过滤、洗涤、灼烧。
(5)①将已经装有溶液的移液管垂直放入稍倾斜的锥形瓶中,使管尖与锥形瓶内壁接触,松开食指使溶液全部流出,数秒后,取出移液管;②用K2Cr2O7溶液进行滴定(还原产物是Cr3+),则有![]() ,溶液这Fe2+的浓度为
,溶液这Fe2+的浓度为![]() ,产品中铁的含量为:
,产品中铁的含量为: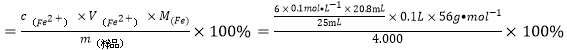 =69.89%
=69.89%


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一氧化碳是一种用途相当广泛的化工基础原料。
⑴.利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
Ni(s)+4CO(g)![]() Ni(CO)4(g)该反应的ΔH_______0(选填“>”或“=”或“<”)。
Ni(CO)4(g)该反应的ΔH_______0(选填“>”或“=”或“<”)。
⑵.在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g);ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g);ΔH2=+172.5 kJ·mol-1
S(s)+O2(g)=SO2(g);ΔH3=-296.0 kJ·mol-1
则2CO(g)+SO2(g)=S(s)+2CO2(g) ΔH4=________。
⑶.工业上一般采用CO与H2反应合成可再生能源甲醇,反应如下:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测
得c(CO)=0.2mol·L-1,则CO的转化率为___________。
合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160。此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
物质 | H2 | CO | CH3OH |
浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
比较此时正、逆反应速率的大小:v正_______v逆 (填“>”、“<”或“=”);若其他条件不变,在T2℃反应10min后达到平衡,c(H2)=0.4 mol·L-1,则该时间内反应速率:v(CH3OH)=__________;
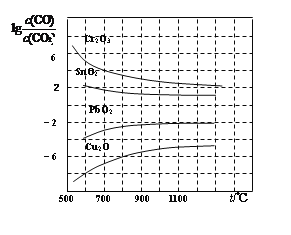
(4)金属氧化物被一氧化碳还原生成金属单质和二氧化碳。下图是四种金属氧化物被一氧化碳还原时lg[c(CO)/c(CO2)]与温度(t)的关系曲线图。800℃时,其中最易被还原的金属氧化物是____(填化学式),该反应的平衡常数数值(K)等于____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前人类已发现几千万种物质,对物质进行分类,有利于我们的学习。下列物质的分类不正确的是
A.S02(酸性氧化物) B.氨水(电解质)
C.HN03 (含氧酸) D.氯水(混合物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知三种一元弱酸的酸性强弱 :HX>HY>HZ,则相同pH的NaX、NaY、NaZ溶液,其物质的量浓度由大到小的顺序正确的是
A.NaX、NaY、NaZ B.NaZ、NaY、NaX
C.NaY、NaZ、NaX D.NaX、NaZ、NaY
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molA气体和2molB气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)若经2s后测得C的浓度为0.6 mol·L-1 ,现有下列几种说法:
2C(g)若经2s后测得C的浓度为0.6 mol·L-1 ,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③ 2s时物质A的转化率为70%
④ 2s时物质B的浓度为0.7mol·L-1
其中正确的是
A、①③ B、①④ C、②③ D、③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重水(D2O)是重要的核工业原料,下列说法错误的是( )
A.H2O与D2O互称同位素
B.氘
C.原子核外有1个电子
D.H与 D中子数不同
E.H218O与D216O的相对分子质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法错误的是
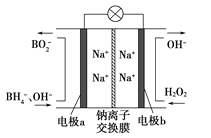
A. 电池放电时Na+从a极区移向b极区
B. 电极b采用MnO2,MnO2既作电极材料又有催化作用
C. 该电池的负极反应为:BH4-+8OH――8e-=BO2-+6H2O
D. 每消耗3molH2O2,转移的电子为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.俄国化学家门捷列夫于1869年发表了第一张元素周期表
B.现代化学常利用原子光谱的特征谱线来测定分子的结构
C.DNA双螺旋的两个螺旋链是用氢键相结合的
D.区分晶体和非晶体最可靠的科学方法是X-射线衍射实验
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com