
【题目】下列说法不正确的是
A.俄国化学家门捷列夫于1869年发表了第一张元素周期表
B.现代化学常利用原子光谱的特征谱线来测定分子的结构
C.DNA双螺旋的两个螺旋链是用氢键相结合的
D.区分晶体和非晶体最可靠的科学方法是X-射线衍射实验
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】Fe2O3俗称氧化铁红,常用作油漆等着色剂。某实验小组用部分氧化的FeSO4为原料,以萃取剂X(甲基异丁基甲酮)萃取法制取高纯氧化铁并进行铁含量的测定。实验过程中的主要操作步骤如下:
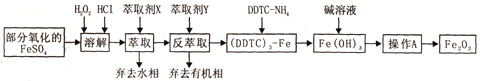
已知:①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮,当盐酸浓度降低时,该化合物解离。
② 3DDTC-NH4+Fe3+= (DDTC) 3-Fe↓+3NH4+
请回答下列问题:
(1)用萃取剂X萃取的步骤中,以下关于萃取分液操作的叙述中,正确的是____________。
A.FeSO4原料中含有的Ca2+、Cu2+等杂质离子几乎都在水相中
B.为提高萃取率和产品产量,实验时分多次萃取并合并萃取液
C.溶液中加入X,转移至分液漏斗中,塞上玻璃塞,如图用力振摇
D.振摇几次后需打开分液漏斗上口的玻璃塞放气
E.经几次振摇并放气后,手持分液漏斗静置待液体分层
F.分液时,将分液漏斗上的玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔,打开旋塞,待下层液体完全流尽时,关闭旋塞后再从上口倒出上层液体
(2)下列试剂中,可作反萃取的萃取剂Y最佳选择是_______________。
A.高纯水 B.盐酸 C.稀硫酸 D.酒精
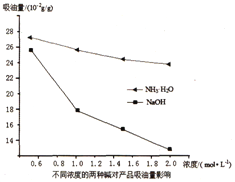
(3)吸油量是反映氧化铁红表面性质的重要指标。吸油量大,说明氧化铁红表面积较大,则用在油漆中会造成油漆假稠,影响质量。不同浓度的两种碱溶液对产物吸油量影响如图所示,则上述实验过程中选用的碱溶液为_______________(填“NaOH”或“NH3·H2O”),反应的化学方程式为_________________。
(4)操作A为______________________。
(5)现准确称取4.000g , 样品,经酸溶、还原为Fe2+,在容量瓶中配成100mL溶液,用移液管移取25.00 mL溶液于锥形瓶中,用0.l000mol/L的K2Cr2O7溶液进行滴定(还原产物是Cr3+),消耗K2Cr2O7溶液20.80mL。
① 用移液管从容量瓶中吸取25.00mL溶液后,把溶液转移到锥形瓶中的具体操作为_____。
② 产品中铁的含量为_______(假设杂质不与K2Cr2O7反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。若再加入双氧水,将发生反应H2O2+2H++2I-═2H2O+I2,且生成I2立即与试剂X反应而被消耗.一段时间后,试剂X将被反应生成I2完全消耗.由于溶液中I-继续被H2O2氧化,生成I2与淀粉作用,溶液立即变蓝.因此,根据试剂X量、滴入双氧水至溶液变蓝所需时间,即可推算反应H2O2+2H++2I-═2H2O+I2反应速率。下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 溶液开始变蓝时间(min) | ||||
0.1mol·L-1 KI溶液 | H2O | 0.01mol·L-1 X溶液 | 0.1mol·L-1 双氧水 | 0.1mol·L-1 稀盐酸 | |||
1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
4 | 20.0 | 0 | 10.0 | 10.0 | 40.0 | 无 | t |
5 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
回答下列问题:
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I-═2H2O+I2反应速率的影响。
实验2中m= ,n= 。
(2)一定温度下,H2O2+2H++2I-═2H2O+I2,反应速率可以表示为v=k·c a(H2O2)·c b (I-)·c(H+)(k为反应速率常数),则:
①实验4时,烧杯中溶液开始变蓝的时间t=__________min;
②根据上表数据可知,a、b的值依次为 和 。
(3)若要探究温度对H2O2+2H++2I-=2H2O+I2反应速率影响,在实验中温度不宜过高且采用水浴加热,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
Zn(s)+1/2O2(g)= ZnO(s) ΔH1 =a kJ/mol;
Hg(l)+1/2O2(g)= HgO(s) ΔH2 =b kJ/mol。
则反应:Zn(s)+HgO(s)= ZnO(s)+Hg(l) △H3 中,△H3的值为
A.(b-a) B.(a-b) C.(a-b)/2 D. (b-a)/2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:①CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是________________________________。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用标准状况下3.36 L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为____________mol,放出的热量为____________kJ(用含有a和b的代数式表示)。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH1=-574 kJ·mol-1①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867 kJ,则ΔH2=____________。
(4)某氮肥厂氨氮废水中的氮元素多以NH![]() 和NH3·H2O形式存在,该废水的处理流程中,NH
和NH3·H2O形式存在,该废水的处理流程中,NH![]() 在微生物作用的条件下经过两步反应被氧化成NO
在微生物作用的条件下经过两步反应被氧化成NO![]() 。两步反应的能量变化示意如图所示:
。两步反应的能量变化示意如图所示:
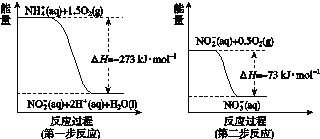
1 mol NH![]() (aq)全部氧化成NO
(aq)全部氧化成NO![]() (aq)的热化学方程式是________________。
(aq)的热化学方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W是短周期中原子序数依次增大的4种主族元素。X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;元素Y 的原子最外层电子数是其内层的3倍;Z元素+2价阳离子的核外电子排布与氖原子相同;W的单质常温常压下为气态。
回答下列问题:
(1)元素W在周期表中位于第 ________ 周期,第 ________ 族。
(2)从空气中获得的X元素单质的电子式: ________ 。
(3)比较Y与Z形成的简单(单原子)离子的半径相对大小:________﹤ (用离子符号表示)。
(4)管道工人曾经用X的氢化物检验W单质是否泄漏。W单质能将X从其气态氢化物中置换出来。试写出该反应的化学方程式: ________ ;W单质泄漏时出现的现象是 ________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.π键是由两个p轨道“头碰头”重叠形成的
B.σ键就是单键,π键就是双键
C.乙烷分子中的键全为σ键,而乙烯分子中含σ键和π键
D.H2分子中含σ键,而Cl2分子中含π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/ mol |
0 | 1.20 | 0.60 |
t1 | 0.20 | |
t2 | 0.80 |
依据题意回答下列问题:
(1)反应在t1min内的平均速率为v(H2)= mol·L-1·min-1
(2)保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)= mol。
(3)温度升至800℃,上述反应平衡常数为0.64,则正反应为 反应(填“放热”或“吸热”)。
(4)700℃时,向容积2L的密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1.20mol、2.00mol、1.20mol、1.20mol,则此时该反应v(正) v(逆)(填“>”、“<”或“=”)。
(5)该反应在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是 、 (写出两种)。
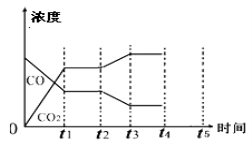
(6)若该容器体积不变,能判断反应达到平衡的是 。
①c(CO)与c(H2)的比值保持不变
②v(CO2)正=v(H2O)逆
③体系的压强不再发生变化
④混合气体的密度不变
⑤体系的温度不再发生变化
⑥气体的平均相对分子质量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com