
【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/ mol |
0 | 1.20 | 0.60 |
t1 | 0.20 | |
t2 | 0.80 |
依据题意回答下列问题:
(1)反应在t1min内的平均速率为v(H2)= mol·L-1·min-1
(2)保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)= mol。
(3)温度升至800℃,上述反应平衡常数为0.64,则正反应为 反应(填“放热”或“吸热”)。
(4)700℃时,向容积2L的密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1.20mol、2.00mol、1.20mol、1.20mol,则此时该反应v(正) v(逆)(填“>”、“<”或“=”)。
(5)该反应在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是 、 (写出两种)。
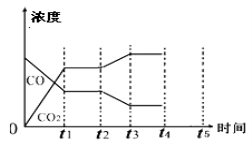
(6)若该容器体积不变,能判断反应达到平衡的是 。
①c(CO)与c(H2)的比值保持不变
②v(CO2)正=v(H2O)逆
③体系的压强不再发生变化
④混合气体的密度不变
⑤体系的温度不再发生变化
⑥气体的平均相对分子质量不变
【答案】(1)0.2/t1 (2)0.40 (3)放热
(4)> (5)降温;提高c(H2O);减小c(H2)
(6)①②⑤
【解析】
试题分析:(1)t1min内消耗水0.4mol,生成氢气0.4mol,反应在t1min内的平均速率为v(H2)=![]() 0.2/t1mol·L-1·min-1; t1min时n(CO)= 0.80,t2min时n(CO)= 0.80,说明t1min时达到平衡状态,则
0.2/t1mol·L-1·min-1; t1min时n(CO)= 0.80,t2min时n(CO)= 0.80,说明t1min时达到平衡状态,则![]() 1,保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=xmol,则
1,保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=xmol,则![]() ,x=0.4mol;(3)温度升至800℃,上述反应平衡常数为0.64,,平衡常数减小,则正反应为放热反应;(4)
,x=0.4mol;(3)温度升至800℃,上述反应平衡常数为0.64,,平衡常数减小,则正反应为放热反应;(4)![]() ,则此时该反应v(正)>v(逆);(5)该反应在t1时刻达到平衡、在t2时刻c(CO2)逐渐增大,c(CO)逐渐减小,说明平衡正向移动,改变条件可能是降温;提高c(H2O);(6)若该容器体积不变,能判断反应达到平衡的是①CO是反应物、H2是生成物c(CO)与c(H2)的比值保持不变,一定平衡; ②正逆反应速率相同,v(CO2)正=v(H2O)逆,一定平衡;
,则此时该反应v(正)>v(逆);(5)该反应在t1时刻达到平衡、在t2时刻c(CO2)逐渐增大,c(CO)逐渐减小,说明平衡正向移动,改变条件可能是降温;提高c(H2O);(6)若该容器体积不变,能判断反应达到平衡的是①CO是反应物、H2是生成物c(CO)与c(H2)的比值保持不变,一定平衡; ②正逆反应速率相同,v(CO2)正=v(H2O)逆,一定平衡;
③![]() ,体系的压强不再发生变化,不一定平衡 ; ④根据
,体系的压强不再发生变化,不一定平衡 ; ④根据![]() ,密度为恒量,混合气体的密度不变 ,不一定平衡; ⑤该反应放热,体系的温度不再发生变化,一定平衡,⑥根据
,密度为恒量,混合气体的密度不变 ,不一定平衡; ⑤该反应放热,体系的温度不再发生变化,一定平衡,⑥根据 ,平均相对分子质量为恒量,气体的平均相对分子质量不变,不一定平衡。
,平均相对分子质量为恒量,气体的平均相对分子质量不变,不一定平衡。


科目:高中化学 来源: 题型:
【题目】据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法错误的是
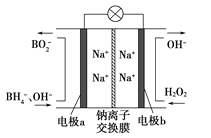
A. 电池放电时Na+从a极区移向b极区
B. 电极b采用MnO2,MnO2既作电极材料又有催化作用
C. 该电池的负极反应为:BH4-+8OH――8e-=BO2-+6H2O
D. 每消耗3molH2O2,转移的电子为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.俄国化学家门捷列夫于1869年发表了第一张元素周期表
B.现代化学常利用原子光谱的特征谱线来测定分子的结构
C.DNA双螺旋的两个螺旋链是用氢键相结合的
D.区分晶体和非晶体最可靠的科学方法是X-射线衍射实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,将10mL 0.1mol/L Na2S2O3溶液和10mL 0.1mol/L的H2SO4溶液混合,3min后溶液中明显出现浑浊。已知温度每升高10℃,化学反应速度增大到原来的3倍,那么40℃时,同样的反应要同样看到浑浊,需要的时间是
A.40s B.15s C.30s D.20s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+Br2(l)=2HBr(g);△H=-72kJ/mol.蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
化学物质 | H2(g) | Br2(g) | HBr(g) |
1mol分子中的化学键断裂时需要吸收的能量/KJ | 436 | a | 369 |
则表中a为( )
A.404 B.260 C.230 D.200
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米材料镍粉(Ni)是一种高性能电极材料。其制备过程如下:
步骤I:取0.2 mol·L-1的硝酸镍溶液,调节pH除铁后,加入活性炭过滤。
步骤Ⅱ:向所得滤液中滴加1.5mol·L-1的NaHCO3溶液使Ni2+完全沉淀,生成xNiCO3·yNi(OH)2·zH2O。
步骤Ⅲ:将产生的沉淀用大量高纯水清洗并用离心机甩干。
步骤Ⅳ:加入稍过量的肼溶液(N2H4·H2O),使上述沉淀还原完全,将生成的Ni水洗后,再用95%的乙醇浸泡后晾干。
⑴步骤I中去除杂质Fe3+(使其浓度<10-6 mol·L-1),需调节溶液pH的范围为___________。(Ksp[Ni(OH)2]=2×10-15,Ksp[Fe(OH)3]=1×10-39)
⑵当x:y:z=1:1:1时,写出步骤Ⅱ中产生沉淀的离子方程式:___________。
⑶步骤Ⅳ中采用95%的乙醇浸泡的目的是___________。
⑷为测定xNiCO3·yNi(OH)2·zH2O的组成,进行如下实验:
①准确称取7.54 g样品与过量的肼溶液(N2H4·H2O)充分反应,共收集到1.12 LN2和CO2混合气体(已换算成标准状况)。
②另取等质量的样品充分灼烧,冷却后称得残留固体NiO的质量为4.5g。
通过计算确定xNiCO3·yNi(OH)2·zH2O的化学式__________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、l0lkPa下,煤炭、氢气、天然气和甲醇(CH3OH)四种燃料的热值(指一定条件下,单位质量的物质完全燃烧所放出的热量)依次是33kJ·g-1、143 kJ·g-1、56 kJ·g-1、23 kJ·g-1。则下列热化学方程式正确的是
A. C(s)+l/2O2(g)=CO(g) △H= -396kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l) △H= -286 kJ·mol-1
C. CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= -896 kJ·mol-1
D. CH3OH(l)+O2(g)=CO2(g)+2H2O(l) △H= -736 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别将四块形状基本相同,质量均为9 g的铁块同时投入到下列四种溶液中,产生氢气速率最快的是( )
A. 200 mL 2 mol·L-1盐酸 B. 50 mL 2 mol·L-1H2SO4溶液
C. 100 mL 3 mol·L-1盐酸 D. 500 mL 6 mol·L-1HNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,向100 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示。下列分析正确的是

A. b点水的电离程度比c点水的电离程度大
B.氢硫酸的酸性比亚硫酸的酸性强
C.原H2S溶液的物质的量浓度为0.05 mol·L-1
D.a点对应溶液的导电性比d点强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com