
【题目】已知H2(g)+Br2(l)=2HBr(g);△H=-72kJ/mol.蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
化学物质 | H2(g) | Br2(g) | HBr(g) |
1mol分子中的化学键断裂时需要吸收的能量/KJ | 436 | a | 369 |
则表中a为( )
A.404 B.260 C.230 D.200
科目:高中化学 来源: 题型:
【题目】下列各项说法正确的是( )
A. “84”消毒液的有效成分是NaClO
B. SO2具有漂白性,可用于加工食品,使食品增白
C. 可以用酒精萃取碘水中碘单质
D. SO2气体通入Ba(NO3)2溶液中不能产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:①CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是________________________________。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用标准状况下3.36 L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为____________mol,放出的热量为____________kJ(用含有a和b的代数式表示)。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH1=-574 kJ·mol-1①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867 kJ,则ΔH2=____________。
(4)某氮肥厂氨氮废水中的氮元素多以NH![]() 和NH3·H2O形式存在,该废水的处理流程中,NH
和NH3·H2O形式存在,该废水的处理流程中,NH![]() 在微生物作用的条件下经过两步反应被氧化成NO
在微生物作用的条件下经过两步反应被氧化成NO![]() 。两步反应的能量变化示意如图所示:
。两步反应的能量变化示意如图所示:
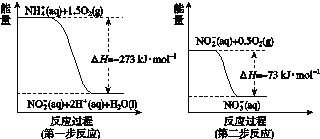
1 mol NH![]() (aq)全部氧化成NO
(aq)全部氧化成NO![]() (aq)的热化学方程式是________________。
(aq)的热化学方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.π键是由两个p轨道“头碰头”重叠形成的
B.σ键就是单键,π键就是双键
C.乙烷分子中的键全为σ键,而乙烯分子中含σ键和π键
D.H2分子中含σ键,而Cl2分子中含π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2A![]() B + D在三种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示,表中温度为摄氏度(℃)。
B + D在三种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示,表中温度为摄氏度(℃)。
实验 序号 | 浓度 时间 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1. 0 | 0.80 | 0.67 | 0.57 | 0.50 | c1 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | T3 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据述数据,回答下列问题 :
(1)在实验1中,以反应物A浓度的变化表示该反应在0~10min内的平均反应速率为________ 。
(2)在实验1中,c1数值为 ________ 。
(3)在实验1、2中有一个实验使用了正催化剂。判断是实验 ________ (选填“1”或“2”)使用了正催化剂。
(4)在实验1、3中反应温度不同。判断T3 ________ 800(选填“﹤”或“﹥”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/ mol |
0 | 1.20 | 0.60 |
t1 | 0.20 | |
t2 | 0.80 |
依据题意回答下列问题:
(1)反应在t1min内的平均速率为v(H2)= mol·L-1·min-1
(2)保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)= mol。
(3)温度升至800℃,上述反应平衡常数为0.64,则正反应为 反应(填“放热”或“吸热”)。
(4)700℃时,向容积2L的密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1.20mol、2.00mol、1.20mol、1.20mol,则此时该反应v(正) v(逆)(填“>”、“<”或“=”)。
(5)该反应在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是 、 (写出两种)。
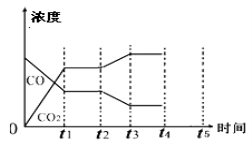
(6)若该容器体积不变,能判断反应达到平衡的是 。
①c(CO)与c(H2)的比值保持不变
②v(CO2)正=v(H2O)逆
③体系的压强不再发生变化
④混合气体的密度不变
⑤体系的温度不再发生变化
⑥气体的平均相对分子质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃下,现有0.1mol·L-1的H2SO4和0.1 mol·L-1一元弱酸HA两种溶液
(1)实验测得0.1 mol·L-1一元弱酸HA 的pH为4,则HA的电离平衡常数Ka= ;
(2)0.1mol·L-1的H2SO4中水电离出的C(H+)为 ;
(3)向0.1mol·L-1的硫酸中加入一定体积的pH=13的NaOH溶液,反应后溶液的pH为2,则所需NaOH溶液与硫酸的体积比为 ;
(4)向0.1 mol·L-1一元弱酸HA加入一定体积的水,在此过程中,下列数值变大的是 ;
①c(H+) ② 电离度(α) ③c(OH-) ④ Ka ⑤c(A-)/ c(HA) ⑥n(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜[xCuCO3·yCu(OH)2],呈孔雀绿颜色.又称为孔雀石,是一种名贵的矿物宝石。它与铜与空气中的氧气、二氧化碳和水蒸气等物质反应产生的物质。CuSO4溶液与Na2CO3溶液反应可以得到碱式碳酸铜,我们将对其组成进行相关探究。
[沉淀制备]
称取12. 5 g胆矾(CuSO4 5H2O)溶于87. 5mL蒸馏水中,滴加少量稀硫酸(体积可以忽略不计),充分搅拌后得到CuSO4溶液。向其中加入Na2CO3溶液,将所得蓝绿色悬浊液过滤,并用蒸馏水洗涤,再用无水乙醇洗涤,最后低溫烘干备用。
[实验探究]我们设计了如下装置,用制得的蓝绿色固体进行实验。

根据以上实验回答下列问题
(1)配制硫酸铜溶液的过程中滴加稀硫酸的作用是___________,所得硫酸铜溶液的溶质质量分数为_________
(2)实验室通常使用加热亚硝酸钠和氯化铵混合溶液的方法制取N2,该反应的化学方程为:__________。
⑶D装置加热前,需要首先打开活塞K,通入适量N2,然后关闭K,再点燃D处酒精灯。通入N2的作
用___________, B为安全瓶,其作用原理为_________,C中盛装的试剂应是__________。
(4)加热D后观察到的现象是________________。
(5)经查阅文献知:Ksp[CaCO3]=2.8×10-9,Ksp[BaCO3]=5.1×10-9,经讨论认为需要用Ba(OH)2溶液代替澄清石灰水来定量测定蓝绿色固体的化学式,其原因是______________
a.Ba(OH)2的碱性比Ca(OH)2强
b.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
c.相同条件下,CaCO3的溶解度明显大于BaCO3
d.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
(6)待D中反应完全后,打开活塞K,再次滴加NaNO2溶液产生N2,其目的是______________。若装置F中使用Ba(OH)2溶液,实验结束后经称量,装置E的质量增加0.27g,F中产生沉淀1.97g。则该蓝绿色固体的化学式为_____________。[写成xCuCO3·yCu(OH)2的形式]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是
A.蒸发:应使混合物中的水分完全蒸干后,才能停止加热
B.蒸馏:开始蒸馏时应先加热再开冷凝水;蒸馏完毕,应先关冷凝水再撤酒精灯
C.分液:下层液体从分液漏斗下口放出后,再将上层液体从下口放出到另一烧杯
D.量取:用规格为10mL的量筒量取8.0mL液体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com