
【题目】CO2既是温室气体,也是重要的化工原料,二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入足量的活性炭和一定量的NO,发生反应C(s)+ 2NO(g) ![]() N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
浓度/(mol/L)/\时间/min | 0 | 10 | 20 | 30 | 40 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
①根据图表数据分析T1℃时,该反应在0~10min内的平均反应速率v(N2)=____________mol·L-1·min-1;计算该反应的平衡常数K=_____________。
②若30min后只改变某一条件,据上表中的数据判断改变的条件可能是____________(填字母编号)。
A.加入合适的催化剂 B.适当缩小容器的体积
C.通入一定量的NO D.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率___________(填“升高”或“降低”),△H______0(填“>”或“<”)。
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式_______________。
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:_________________________。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10 的溶液,则溶液中c(CO32-)∶c(HCO3-)=_______________。[常温下K1(H2CO3)=4.4×10-7、 K
②欲用2LNa2CO3溶液将4.66gBaSO4 固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为__________________________。[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10]。(忽略溶液体积的变化)
【答案】 0.042 4.0 BC 降低 < 2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H=-122.7 kJ·mol-1 CH3OCH3 -12e- + 16OH- = 2CO32- + 11H2O 1:2或0.5 0.11mol/L
CH3OCH3(g)+3H2O(g) △H=-122.7 kJ·mol-1 CH3OCH3 -12e- + 16OH- = 2CO32- + 11H2O 1:2或0.5 0.11mol/L
【解析】试题分析:本题考查化学反应速率和化学平衡常数的计算,外界条件对化学平衡的影响,盖斯定律的应用,燃料电池电极反应式的书写,电离平衡常数的计算,与溶度积有关的计算。
(1)①在0~10min内的平均反应速率υ(N2)=(0.42mol/L-0mol/L)![]() 10min=0.042mol/(L·min)。20min~30min各物质的物质的量浓度不变,说明反应已经达到平衡,即平衡时NO、N2、CO2物质的量浓度依次为0.40mol/L、0.80mol/L、0.80mol/L,该反应的平衡常数K=[c(N2)·c(CO2)]/c2(NO)=
10min=0.042mol/(L·min)。20min~30min各物质的物质的量浓度不变,说明反应已经达到平衡,即平衡时NO、N2、CO2物质的量浓度依次为0.40mol/L、0.80mol/L、0.80mol/L,该反应的平衡常数K=[c(N2)·c(CO2)]/c2(NO)=![]() =4。
=4。
②30min后改变一个条件,40min时NO、N2、CO2的浓度都变为30min时的1.5倍。A项,加入合适的催化剂,平衡不移动,各物质物质的量浓度不变,不可能;B项,适当缩小容器的体积,平衡不移动,但各物质物质的量浓度成比例增大,可能;C项,通入一定量的NO,由于C是固体,相当于增大压强,平衡不移动,但各物质物质的量浓度成比例增大,可能;D项,加入一定量的活性炭,由于C是固体,平衡不移动,各物质物质的量浓度不变,不可能;答案选BC。
③30min时NO、N2、CO2的浓度之比为0.40:0.80:0.80=1:2:2,升高温度NO、N2、CO2的浓度之比为2:3:3,即升高温度平衡向逆反应方向移动,则达到新平衡时NO的转化率降低,逆反应为吸热反应,ΔH![]() 0。
0。
(2)将反应编号,
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH1=-49.1 kJ·mol-1(①式)
CH3OH(g)+H2O(g) ΔH1=-49.1 kJ·mol-1(①式)
2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1(②式)
CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1(②式)
应用盖斯定律,①式![]() 2+②式得2CO2(g)+6H2(g)
2+②式得2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)ΔH=2ΔH1+ΔH2=2
CH3OCH3(g)+3H2O(g)ΔH=2ΔH1+ΔH2=2![]() (-49.1kJ/mol)+(-24.5kJ/mol)=-122.7kJ/mol,反应的热化学方程式为2CO2(g)+6H2(g)
(-49.1kJ/mol)+(-24.5kJ/mol)=-122.7kJ/mol,反应的热化学方程式为2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)ΔH=-122.7kJ/mol。
CH3OCH3(g)+3H2O(g)ΔH=-122.7kJ/mol。
(3)二甲醚氧气电池中电解质为KOH溶液,负极二甲醚被氧化成CO32-,1mol二甲醚失去12mol电子,负极反应式为CH3OCH3-12e-+16OH-=2CO32-+11H2O。
(4)①H2CO3的电离方程式为H2CO3![]() H++HCO3-、HCO3-
H++HCO3-、HCO3-![]() H++CO32-,K2(H2CO3)=[c(H+)·c(CO32-)]/c(HCO3-),则c(CO32-):c(HCO3-)= K2(H2CO3)/c(H+)=5
H++CO32-,K2(H2CO3)=[c(H+)·c(CO32-)]/c(HCO3-),则c(CO32-):c(HCO3-)= K2(H2CO3)/c(H+)=5![]() 10-11
10-11![]() (1
(1![]() 10-10)=1:2。
10-10)=1:2。
②n(BaSO4)=![]() =0.02mol,沉淀转化的离子方程式为BaSO4(s)+CO32-(aq)
=0.02mol,沉淀转化的离子方程式为BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq),该反应的平衡常数K=c(SO42-)/c(CO32-)=Ksp(BaSO4)/Ksp(BaCO3)=1
BaCO3(s)+SO42-(aq),该反应的平衡常数K=c(SO42-)/c(CO32-)=Ksp(BaSO4)/Ksp(BaCO3)=1![]() 10-11
10-11![]() (1
(1![]() 10-10)=0.1;根据离子方程式,当BaSO4固体全部转化时消耗CO32-物质的量为0.02mol,生成的SO42-物质的量为0.02mol,溶液中c(SO42-)=0.02mol
10-10)=0.1;根据离子方程式,当BaSO4固体全部转化时消耗CO32-物质的量为0.02mol,生成的SO42-物质的量为0.02mol,溶液中c(SO42-)=0.02mol![]() 2L=0.01mol/L,溶液中c(CO32-)= c(SO42-)/K=0.01mol/L
2L=0.01mol/L,溶液中c(CO32-)= c(SO42-)/K=0.01mol/L![]() 0.1=0.1mol/L;所用Na2CO3物质的量浓度至少为0.02mol
0.1=0.1mol/L;所用Na2CO3物质的量浓度至少为0.02mol![]() 2L+0.1mol/L=0.11mol/L。
2L+0.1mol/L=0.11mol/L。


科目:高中化学 来源: 题型:
【题目】在25℃时,将两个铂电极插入一定量的饱和Na2SO4溶液中进行电解,通电一段时间后在阳极逸出a mol气体,同时析出w克Na2SO4·10H2O晶体,若温度不变,此时剩余溶液的质量分数是
A. ![]() ×100% B.
×100% B. ![]() ×100%
×100%
C. ![]() ×100% D.
×100% D. ![]() ×100%
×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO3溶液显酸性,溶液中存在以下平衡:HSO3-+H2O![]() H2SO3+OH- ① HSO3-
H2SO3+OH- ① HSO3-![]() H++SO32- ②向 0.1 mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的
H++SO32- ②向 0.1 mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的
A. 加入少量金属 Na,平衡①左移,平衡②右移,溶液中 c(HSO3-)增大
B. 加入少量NaOH溶液,c(SO32-)/c(HSO3-)、c(OH-)/c(H+)的值均增大
C. 加入少量Na2SO3 固体,则 c(H+)+c(Na+)=c(HSO3-)+c(OH-)+1/2c(SO32-)
D. 加入氨水至中性,则 2c(Na+)=c(SO32-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 水、乙醇、乙酸都属于弱电解质
B. 苯与氯气生成 的反应属于取代反应
的反应属于取代反应
C. 分子式为C9H12的芳香烃共有8种
D. 淀粉、油脂、蛋白质都属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯水中含有多种成分,因而具有多种性质,根据氯水分别与如图四种物质作用(四种物质与氯水的重合部分代表物质间的反应,且氯水足量),请回答下列问题:

(1)能证明氯水具有漂白性的是___(填“a”“b”“c”“d”或“e”)。
(2)反应c过程中的现象是___,反应e的化学方程式为___,反应b的化学方程式为___。
(3)久置的氯水最终会变成___,用化学反应方程式表示为___。
(4)实验室保存氯水的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用含钻废料(主要成分为CoCO3,还含有少量NiCO3与铁屑)制备CoCl2·6H2O的工艺流程如下:

已知:①除镍过程中溶液pH对产品中钴的回收率及产品中镍元素的含量的影响如图所示。

②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表所示。
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.5 | 4.1 |
Fe2+ | 7.5 | 9.7 |
Co2+ | 6.6 | 9.4 |
Ni2+ | 6.7 | 9.5 |
回答下列问题:
(1)酸浸后,溶液中的阳离子有Co2+、Ni2+、________。
(2)除镍时,应调节溶液的pH=________,此时Ni2+是否形成Ni(OH)2沉淀?________(填“是”或“否”)。若pH过小,则产品纯度会______(填“升高”“降低”或“不变”)。
(3)酸溶时,当调节溶液的pH为8时,溶液中n(Fe3+):n(Co2+)=______。(已知:Ksp[Co(OH)2]=2.0×10-16,Ksp[Fe(OH)3]=4.0×10-38
(4)除铁时,先向溶液中滴加适量30%H2O2溶液,发生反应的离子方程式为_________;充分反应后再向溶液中加入CoCO3,调节溶液pH的范围为_________,使Fe3+完全转化为Fe(OH)3沉淀,最后过滤得到CoCl2溶液。
(5)已知:Ag++SCN- ==AgSCN↓。为测定粗产品中CoCl2·6H2O的含量,称取11.9g粗产品溶于水配成100mL溶液,从中取出25.00mL,先加入含0.03 mol AgNO3的溶液(杂质不反应),再用0.50molL—1的KSCN溶液滴定过量的AgNO3,该滴定操作所用的指示剂应为______(填化学式)溶液;若消耗20.00 ml KSCN溶液,则该粗产品中CoCl2·6H2O的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是石油裂解气的主要成分之一,以A为原料制备药物中间体X的合成路线如下:

已知i.
ii.![]() 。
。
回答下列同题:
(1)A的结构简式为_________,B的名称为__________,D中含有的官能团的名称是___________。
(2)有机物I的结构简式为___________;反应④的反应类型是___________。
(3)由A生成B的化学方程式为______________________________________。
(4)反应⑧的化学方程式为___________________________________________。
(5)满足以下条件的X的同分异构体有___________种。
i.能发生银镜反应;
ii.含有六元环结构;
iii.六元环上有2个取代基。
其中核磁共振氢谱中有6组峰,且峰面积之比为4:4:3:2:2:1的有机物的结构简式为________(任写一种)。
(6)参照F的合成路线,以CH3CH=CHCH3为原料设计制备 的合成路线:__________(其他试剂任选)。
的合成路线:__________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为组成人体细胞的主要的元素及其比例。下列相关叙述中,错误的是( )

A.图中所示为细胞鲜重中主要的元素的所占比例
B.因为 O 的含量最多,所以 O 是构成有机物的最基本元素
C.细胞干重中,C 所占比例最大
D.图中所示的元素在非生物界也可以找到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法一定正确的是
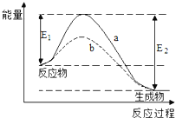
A. 该反应为吸热反应
B. a与b相比,a的反应速率更快
C. a与b相比,反应的平衡常数一定不同
D. 反应物吸收的总能量小于生成物释放的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com