
【题目】下列有关化学平衡常数K、电离平衡常数Ka、水的离子积常数Kw的说法中错误的是
A. 各常数的大小与温度有关 B. 各常数的大小说明平衡体系正反应的程度大小
C. 若温度升高则各常数一定增大 D. 各常数越大反应物平衡转化率越大
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】(1)在一体积为10 L的容器中,通入一定量的CO和H2O,在850 ℃时发生如下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g);ΔH<0。CO和H2O浓度变化如图,则0~4 min的平均反应速率v(CO)=____ mol/(L·min)。
CO2(g)+H2(g);ΔH<0。CO和H2O浓度变化如图,则0~4 min的平均反应速率v(CO)=____ mol/(L·min)。
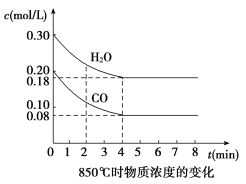
t1 ℃时物质浓度(mol/L)的变化
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c4 |
4 | c1 | c2 | c3 | c4 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
(2)t1 ℃(高于850 ℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。请回答:
①表中3~4 min之间反应处于________状态;c1数值________0.08 mol/L(填大于、小于或等于)。
②反应在4~5 min间,平衡向逆方向移动,可能的原因是________(单选),表中5~6 min之间数值发生变化,可能的原因是________(单选)。
a.增加了水蒸气的量 b.降低温度
c.使用催化剂 d.增加氢气浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,0.1mol/L 的CH3COOH溶液中有l%的CH3COOH分子发生电离,则溶液的pH= ;可以使0.10 mol·L-1 CH3COOH的电离程度增大的是
a.加入少量0.10 mol·L-1的稀盐酸
b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1
d.加入少量冰醋酸
e.加入少量氯化钠固体
f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸)(填“>”、“<”或“=”)。
(3)0.1mol/L的某酸H2A的pH=4,则H2A的电离方程式为 。
(4)25℃时,将pH=9的NaOH溶液与pH=4的盐酸溶液混合,若所得混合溶液的pH=6,则NaOH溶液与盐酸溶液的体积比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘盐中添加的碘酸钾在工业上可用电解KI溶液制取,电极材料是石墨和不锈钢,化学方程式是:KI+3H2O![]() KIO3+3H2↑,有关说法不正确的是( )
KIO3+3H2↑,有关说法不正确的是( )
A.石墨作阳极,不锈钢作阴极
B.I-在阳极放电,H+在阴极放电
C.电解过程中电解质溶液的pH变小
D.电解转移3 mol e-时,理论上可制得KIO3107 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基态Fe原子有________个未成对电子。Fe3+的电子排布式为________。可用硫氰化钾检验Fe3+,形成的配合物的颜色为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)===2HF(g) 的能量变化如图所示,下列有关叙述中正确的是

A.氟化氢气体分解生成氢气和氟气的反应是放热反应
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D.断裂1 mol H—H键和1 mol F—F 键吸收的能量大于形成2 mol H—F键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+4D反应中,表示该反应速率最快的是( )
3C+4D反应中,表示该反应速率最快的是( )
A.υ(A)= 0.5 mol/(L·s) B.υ(B)= 0.3 mol/(L·s)
C.υ(C)= 0.8 mol/(L·s) D.υ(D)= 1 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3O4是重要的化学试剂,其化学式还可以表示为FeO·Fe2O3, 铁粉在氧气中燃烧是制取它最为常见和快捷的方法。图1是制取四氧化三铁的系列装置,A装置用于制取二氧化碳气体,并要求气流稳定,流速可控。


(1)图2中仪器a的名称是_________________。
(2)根据题目要求,在图2中最好选择_____________(填序号)作为A装置。
(3)对图2中装置②进行气密性检查的方法是__________________________。
(4)在B装置中发生的主要反应的化学方程式是_________________________。
(5)反应一段时间后,若将硬质玻璃管中的固体粉末用盐酸溶解,取少许溶液于试管中,加入淀粉碘化钾溶液,没有蓝色出现,推测固体粉末中除Fe3O4外,一定有__________(填名称)。
(6)写出Fe3O4溶于足量稀硫酸的离子方程式 ,要检验所得溶液中的Fe3+,常用试剂是 (填名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com