
����Ŀ������ͼ���رջ���K����A�г���1 molX��1 molY����B�г���2 molX��2 molY����ʱA��B���ݻ�����a L������ͬ�¶Ⱥʹ������ڵ������£�ʹ�������и��Է���������Ӧ��X(g)+Y(g) ![]() 2Z(g)+W(g)����H<0��A���ֺ�ѹ��B���ֺ��ݣ���ƽ��ʱ��A�����Ϊ1.4a L������˵����ȷ���ǣ� ��
2Z(g)+W(g)����H<0��A���ֺ�ѹ��B���ֺ��ݣ���ƽ��ʱ��A�����Ϊ1.4a L������˵����ȷ���ǣ� ��
A����Ӧ���ʣ�v(B)>v(A)
B��B������X��ת����Ϊ80%
C��ƽ��ʱ��ѹǿ��2p(A)=p(B)
D��ƽ��ʱY�����������A>B
���𰸡�A
��������
���������A����X ��g��+Y��g��![]() 2Z��g��+W��g����˵����ʼʱֻ���뷴Ӧ��X��Y���÷�Ӧ��������Ӧ��������Խ�����ѧƽ�⣮������A��˵���ڽ�����ѧƽ��Ĺ����У���Ӧ�����������ʵ����������ݰ���٤�����ɣ�ͬ��ͬ��ʱ��ѹǿ֮�ȵ������ʵ���֮�ȣ��������Ҫ������ֵ����ʵ���Ũ�Ⱦ�Ҫ���£��䷴Ӧ����ҲҪ��С������B������˵��������䣬����ֳ�ʼŨ����A������2����ÿ��ʱ�̵ķ�Ӧ���ʶ�������A����������Ӧ���ʣ�v��B����v��A����A����ȷ��B.���ݰ���٤�����ɣ���ƽ������������ʵ����dz�ʼʱ���ʵ�����1.4������1.4��2mol=2.8mol����������0.8mol�����ݻ�ѧ����ʽ�ļ����֪��
2Z��g��+W��g����˵����ʼʱֻ���뷴Ӧ��X��Y���÷�Ӧ��������Ӧ��������Խ�����ѧƽ�⣮������A��˵���ڽ�����ѧƽ��Ĺ����У���Ӧ�����������ʵ����������ݰ���٤�����ɣ�ͬ��ͬ��ʱ��ѹǿ֮�ȵ������ʵ���֮�ȣ��������Ҫ������ֵ����ʵ���Ũ�Ⱦ�Ҫ���£��䷴Ӧ����ҲҪ��С������B������˵��������䣬����ֳ�ʼŨ����A������2����ÿ��ʱ�̵ķ�Ӧ���ʶ�������A����������Ӧ���ʣ�v��B����v��A����A����ȷ��B.���ݰ���٤�����ɣ���ƽ������������ʵ����dz�ʼʱ���ʵ�����1.4������1.4��2mol=2.8mol����������0.8mol�����ݻ�ѧ����ʽ�ļ����֪��
X ��g��+Y��g��![]() 2Z��g��+W��g����n
2Z��g��+W��g����n
1 1
0.8mol 0.8mol
����ƽ���Ӧ��0.8mol��A������X��ת����Ϊ80%��������B��˵���൱����Aƽ��Ļ���������ѹǿ��ƽ�������ƶ���X��ת��ΪС��80%��B�����C.Bƽ���൱����Aƽ��Ļ���������һ��ѹǿ����ƽ�ⲻ�ƶ���2p(A)=p(B)��ʵ���ϣ�ƽ�����淴Ӧ�����ƶ�����2p(A)>p(B)��C�����D.����C����A������ƽ��仯��������ƽ����ݻ�Ϊ0.5aL���ݻ�Ϊ1.4aL��ȣ�Y���������Ҫ��С����ƽ��ʱY�������A��B��D�����ѡA��


 ����ȫ���ִʾ��ƪ��ϵ�д�
����ȫ���ִʾ��ƪ��ϵ�д� �����߿����ϵ�д�
�����߿����ϵ�д� �㾦�½̲�ȫ�ܽ��ϵ�д�
�㾦�½̲�ȫ�ܽ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH3��һ����Ҫ�Ļ���ԭ����Ҳ�����ˮ�帻Ӫ����������������Ⱦ����Ҫ����֮һ��
��1��N2��H2�����ʵ���֮��Ϊ1��3�ڲ�ͬ�¶Ⱥ�ѹǿ�·�����Ӧ��N2��3H2![]() 2NH3�����ƽ����ϵ��NH3�����ʵ���������ͼ1��
2NH3�����ƽ����ϵ��NH3�����ʵ���������ͼ1��
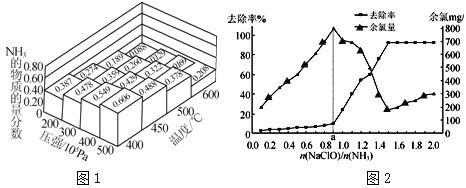
��Ϊ���ԭ������ת���ʣ���ҵ�ϲ�ȡ�ĺ�����ʩ�� ������ĸ����
a. ��������
b. ʹ���ʵ��Ĵ���
c. ��ԭ������ѹ
d. ����Һ������������
��ͼ1����ʾ��ƽ����ϵ��NH3�����ʵ�������Ϊ0.549��0.488ʱ���÷�Ӧ��ƽ�ⳣ���ֱ�ΪK1��K2����K1 K2���������������������
��2�����������ˮ�帻Ӫ��������Ҫ����֮һ���ô�������ˮ�����ɵĴ����Ὣˮ�еİ�������NH3��ʾ��ת��Ϊ������ȥ���漰����ط�Ӧ���£�
��Ӧ����NH3��HClO===NH2Cl��H2O
��Ӧ����NH2Cl��HClO===NHCl2��H2O
��Ӧ����2NHCl2��H2O===N2��HClO��3HCl
��֪��ˮ��Һ��NH2Cl���ȶ���NHCl2���ȶ���ת��Ϊ����������������һ������������ı�![]() ����NaClO��Һ��Ͷ����������Һ�д������ƶ���ȥ���ʼ������� ����Һ�У�1����Ԫ�صĺ�������Ӱ����ͼ2��ʾ��
����NaClO��Һ��Ͷ����������Һ�д������ƶ���ȥ���ʼ������� ����Һ�У�1����Ԫ�صĺ�������Ӱ����ͼ2��ʾ��
����Ӧ�а���ȥ��Ч����ѵ�n��NaClO��/n��NH3��ֵԼΪ ��
��a��֮ǰ����ȥ���ʽϵ͵�ԭ��Ϊ ��
��3��������Ṥҵ��β��NO���Ʊ�NH4NO3���乤��ԭ����ͼ3��
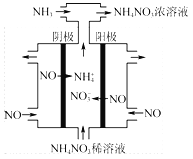
������������������������Ӧ�����ӷ���ʽΪ ��
����������ɵ�HNO3ȫ��ת��ΪNH4NO3����ͨ���NH3��ʵ�ʲμӷ�Ӧ��NO�����ʵ���֮������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ��ѡ��2����ѧ�뼼��]
��ˮռ�����ܴ�ˮ����97.2�������Ѻ�ˮ�����ͻ�������������������ܽ����ˮ��Դȱ�������⣬���ܳ�����ú�����Դ��
��ͼ�����ú�ˮ��Դ���л��������IJ��ֹ�������ʾ��ͼ��

��1���ù�������ʾ��ͼ�а����� �� ���ѧ��ҵ�����ƣ���
��2�������̢��У�����ȥ�����к��е�Ca2����Mg2����SO42�������ӣ��轫�����ܽ��˳�����ҩƷ���г��������˵ȡ�����ҩƷ�Ͳ�����˳������� ������ĸ����
A��Na2CO3��NaOH�� BaCl2�����ˡ�����
B��NaOH�� BaCl2�� Na2CO3�����ˡ�����
C��NaOH�� Na2CO3�� BaCl2�����ˡ�����
D��BaCl2��Na2CO3�� NaOH�� ���ˡ�����
��3�����̢��У�ͨ�翪ʼ�������������������� (�ѧʽ)������������ҺpH�� �����������С�����䡱����
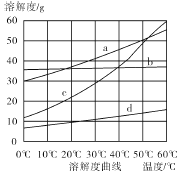
��4�����̢��У�ͨ����Ӧ��ѧ��Ӧ���Եõ�NaHCO3���塣��ͼΪNaCl��NH4Cl��NaHCO3��NH4HCO3���ܽ�����ߣ������ܱ�ʾNaHCO3�ܽ�����ߵ��� ������NaHCO3����Ļ�ѧ��Ӧ����ʽ�� ��
��5�����̢��У����ô�������������������ʣ����õ��ᴿ������ �������ƣ���ͨ���÷��ᴿ��õ�������Na2CO3��10H2O��Na2CO3��10H2O��ˮ�õ���ˮ̼���ơ�
��֪��Na2CO3��H2O(s)=Na2CO3(s)+H2O(g) ��H1=+58.73kJ��mol-1
Na2CO3��10H2O(s)=Na2CO3��H2O(s)+9H2O(g) ��H2=+473.63 kJ��mol-1
����ˮ���̲�������̬ˮ��ȫҺ���ͷŵ�����ȫ����������Na2CO3������ܺģ�������������ʧ����������1molNa2CO3��Ҫ����92.36kJ���ɴ˵ó���H2O(g��= H2O(l) ��H= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʼ��仯�����ڹ�ũҵ������������Ҫ��Ӧ�á�
��1����֪25��ʱ��SO2��g����2CO��g����2CO2��g����1/x Sx��s�� ��H��akJ/mol
2COS��g����SO2��g����2CO2��g����3/x Sx��s�� ��H��bkJ/mol��
��COS��g������CO��g����Sx��s����Ӧ���Ȼ�ѧ����ʽ�� ��
��2���ƻ�(As2S3)����ȡ�����Ҫ����ԭ�ϡ���֪As2S3���Ժ�ŨHNO3��Ӧ��������0.6mol��H3AsO4ʱ����Ӧ��ת�Ƶ��ӵ���ĿΪ3NA����As2S3��ŨHNO3��Ӧ�ķ���ʽ��
��3��������ʵ���Ũ��Na2S��NaOH�����Һ�еμ�ϡ����������������H2S��HS��S2�ķֲ�������ƽ��ʱij���ֵ�Ũ��ռ������Ũ��֮�͵ķ�������μ���������Ĺ�ϵ����ͼ��ʾ�����Եμӹ���H2S������ݳ�����
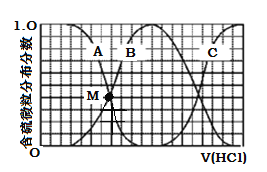
������B��ʾ �ķֲ�������
�ڵμӹ����У���Һ����Ũ�ȴ�С��ϵ��ȷ���� (����ĸ)��
A��c(Na+)= c(HS)+2c(S2)
B��3c(H2S)+2c(HS)+c(S2)+c(H+)=c(OH)
C��3c(Na+)=[c(H2S)+c(HS)+c(S2)]
��NaHS��Һ�ʼ��ԣ����μ�������M�㣨A��B���ߵĽ���㣩ʱ����Һ�и�����Ũ���ɴ�С��˳��Ϊ
��4����ҵ������·ѭ����������������Ĺ�����������ͼ��ʾ��
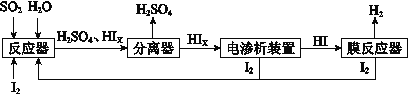
��д����Ӧ���з�����Ӧ�Ļ�ѧ����ʽ�� ��
�ڵ�����װ������ͼ��ʾ
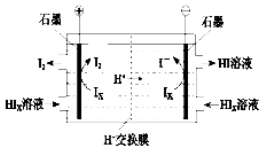
д�������ĵ缫��Ӧʽ ��
��װ���з������ܷ�Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I����֪��ϡ��Һ�У��������кͷ�Ӧ����1molˮʱ�ķ�Ӧ�Ƚ����к��ȡ���������ͼװ�ý����к��ȵIJⶨ����ش��������⣺
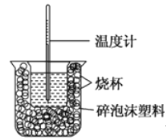
��1����ͼ��������δ�����������ֱ���______��______��
��2����һ���������к��Ȳⶨʵ�飬�¶ȼ���ʹ��______����
��3�����¶�Ϊ13�棬Ũ��Ϊ1.0mol/L������Һ��1.1mol/L�ļ���Һ��50mL��ϣ���Һ�ܶȾ�Ϊ1g/mL����������Һ�ı�����c=4.184J/(g��)�������������������Һ���¶ȱ仯�������£�
��Ӧ�� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | �к��� |
HCl+NaOH | 13 | 19.8 | ��H1 |
HCl+NH3H2O | 13 | 19.3 | ��H2 |
���Ƚ���H1����H2����Դ�С����H1 ��H2����������������������������
������ʵ���������ԭ���� ��
��д��HCl��NH3H2O��Ӧ���Ȼ�ѧ����ʽ�� ��
II������ͼ��ʾ��������Բ����ֽ�ֱ��۵���©��״������һ��ʹ���ܶ����IJ㡣���ڲ���ֽȡ�����ڵײ���һ��С�ף���ˮ��ʪ���ٸ���һֽ©������һ�𣬼�����Ȧ�ϣ��������һʢɳ��������5 g�������������ĩ��2 g���ۻ�Ͼ��ȣ�����ֽ©���У��������������ز��ڻ�����м��һ��þ������Сľ����ȼþ�����۲췢��������ͨ������ʵ����Ϣ���ش��������⣺
��1��д���÷�Ӧ�Ļ�ѧ����ʽ��__________���÷�Ӧ��Ϊ________��Ӧ��
��2��ѡ����ʵ���ʵ������(��д�ں�����)��________��
��þ������ȼ�� ���ų��������ȣ�������ҫ�۵Ĺ�â����������
��ֽ©�����²����մ� ���к���״̬��Һ�������������ڵ�ϸɳ�ϣ�Һ����ȴ���Ϊ��ɫ����
��3��д�������ʵ����ã�������ʢɳ��________��þ����________������أ�________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵��û�п�ѧ�Դ������ �� ��
A. ����ѩ����Ư�ۿ���������ɫ������Ȼʧ��ɫ����û����ף�ֻ�и���
B. CO�ж�������ú¯�ľ��ң��ɷ���������ˮ����������Ч������CO����ֹú���ж�
C. �Ȼ��ƾ�����ˮ�Ժͳ����ԣ�������������ˮ��Һ��������·������Ч�ر���·��
D. ��Ԫ���ж�����ֹ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����K2Cr2O7��Һ����FeSO4��Ӧ����Fe3+��Cr3+���ֽ������ữ��K2Cr2O7��Һ��FeSO4��Һ��ϣ���ַ�Ӧ������������Һ�м���KI��Һ�������Һ��Fe3+�����ʵ���������KI�����ʵ����ı仯��ϵ��ͼ��ʾ������˵���в���ȷ���ǣ� ��
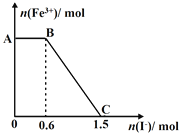
A. ͼ��AB�ε�������ΪK2Cr2O7
B. ͼ��BC�η����ķ�ӦΪ2Fe3++2I-=2Fe2++I2
C. ��ʼ�����K2Cr2O7Ϊ0.25 mol
D. K2Cr2O7����FeSO4��Ӧ�����ʵ���Ϊ1��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵ���������;���ж�Ӧ��ϵ����
A���������������ԣ�����������ˮ��������
B������̿���л�ԭ�ԣ�����������ҵ��ɫ��
C���������������ԣ�������������ʴ�̼�
D���������������ԣ�������ʳƷ��ҵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
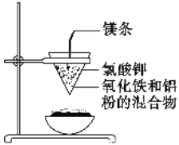
����Ŀ�����ӹ�ҵ�У������Ȼ�����Һ��Ϊӡˢ��·ͭ��ʴ��Һ���밴Ҫ��ش��������⣺
��1�������Ȼ�����Һ�м���һ�����ij���ʯ��ˮ��������ҺpH���ɵú��ɫ����,�÷�Ӧ�����ӷ���ʽΪ��______________________________________���ù����е�����Һ��pHΪ5����c(Fe����)Ϊ��____________mol��L��1������֪��Ksp[Fe(OH)3]= 4.0��10-38��
��2��ij̽��С�����������·������Һ����Դ���գ�
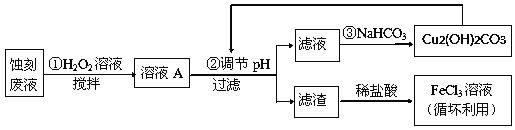
��������FeCl3��Һʴ��ͭ���ķ�Һ�к��еĽ����������У�_______________��
��FeCl3ʴ��Һ��ͨ������һ���������ᣬ���м��������Ŀ���ǣ�_________________��
�۲�����м���H2O2��Һ��Ŀ���ǣ�______________________________________��
����֪�������������������pH
Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
��ʼ����ʱ | 4.7 | 7.0 | 1.9 |
������ȫʱ | 6.7 | 9.0 | 3.2 |
���ݱ��������Ʋ����pH�ķ�Χ�ǣ�________________��
��д�������������CO2�����ӷ���ʽ��__________����֪Cu2(OH)2CO3������ˮ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com