
【题目】SO2的含量是衡量大气污染的一个重要指标,工业上常采用催化还原法或吸收法处理SO2。利用催化还原SO2不仅可消除SO2污染,而且可得到有经济价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和H2O。
己知CH4和S的燃烧热(△H)分别为-890.3 kJ /mol和-297.2 kJ /mol,则CH4和SO2反应的热化学方程式为 _________________________________________________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:

①分析可知X为________(写化学式), 0~t1时间段的温度为_____, 0~t1时间段用SO2表示的化学反应速率为 ___________________________。
②总反应的化学方程式为__________________________________________________________。
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
①该反应的△H _________________________ 0 (填“>”或“<”)
②计算700℃该反应的平衡常数为____________________ 。

【答案】CH4(g)+2SO2(g)=CO2(g)+2S(s)+2H2O(l) △H=-295.9kJ/mol H2S 300℃ 2×10-3/t1mol/(Lmin) 2H2+SO2![]() S+2H2O < 36.45mol/L
S+2H2O < 36.45mol/L
【解析】
(1)CH4的燃烧的热化学反应方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1 ①,S燃烧的热化学反应方程式为S(s)+O2(g)=SO2(g) △H=-297.2kJ·mol-1 ②,CH4和SO2反应的方程式为CH4+2SO2=2S+CO2+2H2O,
因此有①-2×②得出CH4(g)+SO2(g)=2S(s)+CO2(g)+2H2O(l) △H=(-890.3+2×297.2)kJ·mol-1=-295.9kJ·mol-1;
(2)①H2还原SO2发生反应:2H2+SO2=S+2H2O,图1右侧,SO2→S,S元素的化合价降低,根据氧化还原反应特点,化合价有升高,必然有降低,因此推出X为H2S;0~t1时间,X的浓度达到最大,应是图1左侧反应,4H2+SO2=H2S+2H2O,温度应为300℃;根据化学反应速率的表达式,v(SO2)=(3-1)/t1mol/(L·min);
②根据上述分析,总反应的化学方程式为2H2+SO2![]() S+2H2O;
S+2H2O;
(3)①根据图像,700℃SO2的转化率达到最大,反应达到平衡,右侧随着温度的升高,SO2的转化率降低,根据勒夏特列原理,正反应为放热反应,即△H<0;
②2C(s)+2SO2(g)![]() S2(g)+2CO2(g)
S2(g)+2CO2(g)
起始: 1 0 0
变化: 0.9 0.45 0.9
平衡: 0.1 0.45 0.9 化学平衡常数的表达式为K=[c(S2)×c2(CO2)]/c2(SO2),代入数值,得出K=36.45。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g) + 6H2O(g),下列叙述正确的是
4NO(g) + 6H2O(g),下列叙述正确的是
A.平衡时,v正(O2)=v逆(O2)必成立
B.关系式5v正(O2)=4v正(NO)总成立
C.用上述四种物质NH3、O2、NO、H2O表示的正反应速率的数值中,v正(H2O)最小
D.若投入4 mol NH3和5 mol O2,通过控制外界条件,必能生成4 mol NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 可用蒸发结晶的方法从碘水中提取碘单质
B. 碘化银可用于人工降雨
C. 酒精在实验台上着火可用水作灭火剂
D. 氢气还原氧化铜要先加热再通氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物中,既不能与NaOH溶液发生反应,又不能与溴的CCl4溶液反应,也不能使酸性KMnO4溶液褪色的是
A.丙烷B.乙醇
C.乙酸D.丙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液电导率越大导电能力越强。常温下用0.0200mol/L盐酸分别滴定10.00mL浓度均为0.0200mol/L的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似)。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是
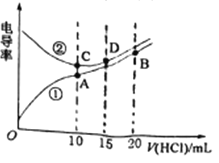
A. 曲线②代表滴定NaOH溶液的曲线,在相同温度下,水的电离程度A>C>D>B
B. 常温下,测得A点溶液的pH=6,则二甲胺常温下电离常数Kb约为10-4
C. 向二甲胺溶液中滴加盐酸10~20mL过程中:c(Cl-)>c[(CH3)2NH2+]>c(H+)>c(OH-)
D. B点溶液中:c(H+)=c(OH-)+ c[(CH3)2NH2+]+2c[(CH3)2NH·H2O]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅的说法正确的是( )
A.单质硅的导电性介于导体和绝缘体之间
B.单质硅是制造光导纤维的材料
C.硅为非金属,熔点低,但有金属光泽
D.晶体硅为非金属,属于绝缘体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、硼、硅、砷等元素的化合物是制造新型激光武器和新型太阳能电池的重要材料。回答下列问题:
(1)基态硅原子电子占据的最高能层符号是_____,其中能量最高的电子所占据能级的原子轨道有_____个伸展方向,原子轨道呈_____形。
(2)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有____________。
(3)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的第一电离能从大到小的顺序为________(用元素符号表示)。H2SeO3的酸性_______H2SeO4(填“强于”或“弱于”),原因是___________(从分子结构的角度回答)。
(4)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。它的晶体结构如下左图所示。六方相氮化硼______π键(填“含有”或“不含”),其质地软的原因是_________。NaBH4是一种重要的储氢载体,阴离子的的立体结构为_______。
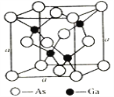
(5)砷化镓是优良的第三代半导体材料。如上图所示为GaAs的晶胞结构。
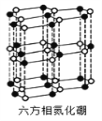
①与GaAs互为等电子体的一种原子晶体的化学式为________。
②已知晶胞的密度是ρ g·cm3,阿伏加德罗常数值为NA,棱长a=_____pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下按照相同物质的量投料发生反应:CO(g)+2H2(g)CH3OH(g)△H<0.测得CO的平衡转化率与压强的关系如图所示。有关说法正确的是( )
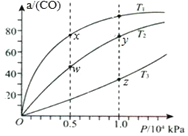
A. 混合气体密度:ρ(x)>ρ(w) B. 正反应速率:v正(y)>v正(w)
C. 反应温度:T2>T3 D. 混合气体的平均摩尔质量:M(y)<M(z)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com