
【题目】在不同温度下按照相同物质的量投料发生反应:CO(g)+2H2(g)CH3OH(g)△H<0.测得CO的平衡转化率与压强的关系如图所示。有关说法正确的是( )
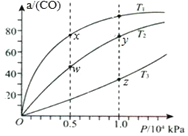
A. 混合气体密度:ρ(x)>ρ(w) B. 正反应速率:v正(y)>v正(w)
C. 反应温度:T2>T3 D. 混合气体的平均摩尔质量:M(y)<M(z)
【答案】B
【解析】
A. 由m=ρV结合混合气体的质量、体积可以知道,混合气体的质量不变,若体积不变时,混合气体密度: ρ(x)=ρ(w),故A错误;
B. y、w的温度相同,y点对应压强大,压强越大反应速率越快,则反应速率: v正(y)>v正(w),故B正确;
C. △H<0,根据图像可知,在压强相同时,温度升高,平衡左移,一氧化碳的转化率减小,则反应温度: T2<T3 ,故C错误;
D. D.y、z比较,y点CO转化率大,则平衡时混合气体的总物质的量小,y点对于气体的物质的量小,因为反应后气体的总质量不变,则混合气体的平均摩尔质量: M(y)>M(z),故D错误;
综上所述,本题选B。


科目:高中化学 来源: 题型:
【题目】SO2的含量是衡量大气污染的一个重要指标,工业上常采用催化还原法或吸收法处理SO2。利用催化还原SO2不仅可消除SO2污染,而且可得到有经济价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和H2O。
己知CH4和S的燃烧热(△H)分别为-890.3 kJ /mol和-297.2 kJ /mol,则CH4和SO2反应的热化学方程式为 _________________________________________________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:

①分析可知X为________(写化学式), 0~t1时间段的温度为_____, 0~t1时间段用SO2表示的化学反应速率为 ___________________________。
②总反应的化学方程式为__________________________________________________________。
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
①该反应的△H _________________________ 0 (填“>”或“<”)
②计算700℃该反应的平衡常数为____________________ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是金属镁和卤素单质(X2)反应的能量变化示意图。下列叙述中,正确的说法有几项 ( )

①Mg(s)所具有的能量高于MgX2(s)所具有的能量
②MgCl2电解制Mg(s)和Cl2(g)是吸热过程
③热稳定性:MgI2>MgBr2>MgCl2>MgF2
④常温下氧化性:F2<Cl2<Br2<I2
A. 1项 B. 2项
C. 3项 D. 4项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质(括号的物质为杂质)的方法中,错误的是
A. FeCl3溶液(FeCl2):通入适量Cl2
B. CO(CO2):通过NaOH溶液洗气后干燥
C. MnO2(KCl):加水溶解后过滤、洗涤、烘干
D. CO2(HCl):通过饱和Na2CO3溶液洗气后干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用某些有机物之间的相互转换可以贮存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)的反应为
 △H=+88.62 kJ/mol
△H=+88.62 kJ/mol
以下叙述错误的是________(填序号)
a.NBD的能量比Q的能量高 b.NBD和Q互为同分异构体
c.NBD的分子式为C7H8 d.NBD能使溴水褪色
e. NBD及Q的一氯代物均为三种
(2)如图是在一定温度下,某固定容积的密闭容器中充入一定量的NO2气体后,反应速率(v)与时间(t)的关系曲线。下列叙述正确的是______。

a.t1时,反应未达到平衡, NO2浓度在减小
b.t2时,反应达到平衡,反应不再进行
c.t2~t3,各物质浓度不再变化
d.t2~t3,各物质的浓度相等
e.0~t2,N2O4浓度增大
f.反应过程中气体的颜色不变
(3)某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:

①在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过定量测定锌完全消失所需的时间进行判断,其速率最快的实验是_____(填实验序号)。
②对锌和稀硫酸反应,实验1和2表明,____对反应速率有影响,实验1和3表明,____对反应速率有影响
③进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图像如图所示。在OA、AB、BC三段中反应速率最快的是_______,2~4min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)=_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】click“点击化学”是一种绿色、高效的有机合成手段。其中铜(Ⅰ)催化的炔-叠氮基的点击反应获得五元杂环三氮唑在医药领域有广泛的用途。由芳香化合物A合成G的过程如下:

已知:a.tBu代表叔丁基![]()
b. 
(1)A的名称为___________,下列关于A的说法正确的是___________ (填字母)。
a属于芳香烃 b.遇FeCl3溶液显紫色
c苯环上的一溴代物有两种 d不能发生氧化反应
(2)B的结构简式为___________,其分子中最多有___________个原子共平面。
(3)化合物F到G的反应类型为_________________________________。
(4)书写化合物D到E化学方程式_________________________________。
(5)D的一种同分异构体H能与碳酸氢钠反应,且核磁共振氢谱峰面积比为6︰1,H的结构简式为________。
(6)索烃是一种类似锁链没有化学键连接的多个环状分子组合休。“click”反应广泛用于合成类索烃的基本单元。以![]() 为原料,仿照流程中“click”反应,书写合成环状分子
为原料,仿照流程中“click”反应,书写合成环状分子 的路线,有机试剂和无机试剂任选。________________
的路线,有机试剂和无机试剂任选。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。许多科学家认为从空气中捕获二氧化碳不仅在理论上可行,很快还会成为一个对付全球变暖的实用武器;目前NH3和(NH4)2CO3等物质已经被用作工业捕碳剂。
(1)下列物质中不可能作为CO2捕获剂的是___________。
A.Na2CO3 B.HOCH2CH2NH2 C.CH3CH2OH D.NH4Cl
(2)工业上用NH3捕碳可合成CO (NH2)2:
已知:①标准状况下,11.2L NH3与足量CO2完全反应生成NH2CO2 NH4 (s)时放出39.8kJ的热量;②NH2CO2 NH4 (s)= CO(NH2)2(s)+ H2O(g) △H=+72.5 KJ·mol-1。
则2NH3(g)+CO2(g)=CO(NH2)2(s)+ H2O(g)的△H=_____________KJ·mol-1。
(3)用(NH4)2CO3捕碳的反应如下:
(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2(NH4)2HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
2(NH4)2HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:

①c点的逆反应速率和d点的正反应速率的大小关系为V逆c _____V正d (填“>”、“=”或“<”)
②b、c、d三点的平衡常数K b 、K c、 Kd 从大到小的顺序为 _____________。(填“>”、“=”或“<”)
③在T2~T4温度区间,容器内CO2气体浓度呈现先减小后增大的变化趋势,其原因是________。
(4)用碱性溶液也可捕碳:在常温下,将0.04mol CO2通入200mL 0.2mol/L的Na2S溶液中,已知: H2CO3的电离平衡常数:K1=4.3×10—7、K2=5.6×10—11;H2S的电离平衡常数:K1=5.0×10—8、K2=1.1×10—12。回答下列问题
①发生反应的离子方程式为_____________________________
②充分反应后下列关系式中正确的是_____________________
A.(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)
B.c(CO32-)+ c(HCO3-)+ c(H2CO3)>c(H2S)+c(HS-)+c(S2-)
C.c(Na+)>c(HCO3-)>c(HS-)>c(OH-)
③计算反应后的溶液中c(H2S).c(OH-)/c(HS-)的值为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(gL-1)如图所示。已知盐酸浓度大于1molL-1时,发生反应:PbCl2(s)+2Cl-(aq)═PbCl42-(aq)。下列叙述正确的是
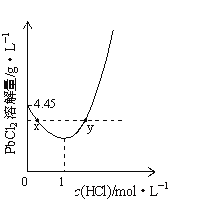
A. 盐酸浓度越小,Ksp(PbCl2)越小
B. x、y两点对应的溶液中c(Pb2+)相等
C. 当盐酸浓度为1molL-1时,溶液中c(Pb2+)一定最小
D. 当盐酸浓度小于1molL-1时,随HCl浓度增大,PbCl2溶解量减少是因为Cl-浓度增大使PbCl2溶解平衡逆向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com