
【题目】常温下,pH=11的氨水和pH=1的盐酸等体积混合(混合溶液体积为两溶液体积之和),恰好完全中和,则下列说法错误的是( )
A. 氨水的浓度等于盐酸的浓度
B. 原氨水中有1%的含氮微粒为NH4+
C. 氨水中水电离出的c(H+)是盐酸中水电离出的c(H+)的100倍
D. 混合溶液中c(NH4+)+c(NH3·H2O)+c(NH3)=5×10-4mol·L-1
【答案】D
【解析】试题分析:等体积的氨水与盐酸混合后,恰好完全反应,所以一水合氨与氯化氢的物质的量相等,因二者等体积混合,则物质的量浓度相等,都是0.1mol/L, A正确;由分析可知,pH=11的氨水溶液浓度为0.1mol/L,则电离产生的c(OH-)=c(NH4+)=10-3mol/L,则原氨水中NH4+的含量为![]() =1%, B正确; 氨水中的氢离子是水电离的,pH=11的氨水中水电离的氢离子浓度为10-11mol/L,盐酸中的氢氧根离子是水电离的,盐酸中水电离的氢氧根离子与氢离子浓度相等为,10-13mol/L,所以氨水中水电离出的c(H+)是盐酸中水电离出的c(H+)的100倍, C正确;反应后的溶液中NH4+、NH3H2O与NH3三种微粒的平衡浓度之和为
=1%, B正确; 氨水中的氢离子是水电离的,pH=11的氨水中水电离的氢离子浓度为10-11mol/L,盐酸中的氢氧根离子是水电离的,盐酸中水电离的氢氧根离子与氢离子浓度相等为,10-13mol/L,所以氨水中水电离出的c(H+)是盐酸中水电离出的c(H+)的100倍, C正确;反应后的溶液中NH4+、NH3H2O与NH3三种微粒的平衡浓度之和为![]() =0.05molL-1, D错误。
=0.05molL-1, D错误。


科目:高中化学 来源: 题型:
【题目】与纯水的电离相似,液氨中也存在着微弱的电离:2NH3![]() NH4++NH2-.某温度下,液氨的离子积常数K=c(NH4+)·c(NH2-)=1.6×10-29,若用定义pH一样来规定pN=-lg c(NH4+),则在该温度下,下列叙述正确的是
NH4++NH2-.某温度下,液氨的离子积常数K=c(NH4+)·c(NH2-)=1.6×10-29,若用定义pH一样来规定pN=-lg c(NH4+),则在该温度下,下列叙述正确的是
A. 纯净的液氨中,pN=7
B. 液氨达到电离平衡时c(NH3)=c(NH4+)+c(NH2-)
C. 1 L溶解有0.001 mol NH4C1的液氨溶液,其pN=3
D. 1 L溶解有0.001 mol NaNH2的液氨溶液,其pN=11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关![]() 分子结构的下列叙述中正确的是
分子结构的下列叙述中正确的是
①除苯环外的其余碳原子有可能都在一条直线上
②除苯环外的其余碳原子不可能都在一条直线上
③12个碳原子不可能都在同一平面上
④12个碳原子有可能都在同一平面上
A. ①② B. ②③ C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于主族元素的说法正确的是( )
A.主族元素的原子核外电子最后填入的能级是s能级
B.主族元素的原子核外电子最后填入的能级是s能级或p能级
C.所有主族元素的最高正价都等于主族序数
D.主族元素的价电子数有可能超过最外层电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。
(资料查阅)
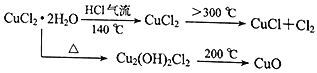
(实验探究)该小组用下图所示装置进行实验(夹持仪器略)。
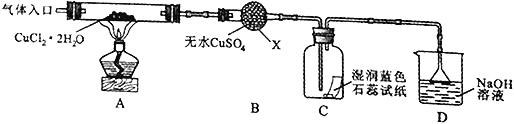
请回答下列问题:
(1)实验操作的先后顺序是a→_______________→e(填操作的编号)。
a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(2)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是_______。
(3)装置D中发生的氧化还原反应的离子方程式是________________。
(4)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息
①若杂质是CuCl2,则产生的原因是________________。
②若杂质是CuO,则产生的原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下图装置进行喷泉实验,已知圆底烧瓶内充满X气体,胶头滴管内装有少量Y液体,烧杯内装有足量Z液体,下列组合能进行喷泉实验且最终液体一定能充满整个烧瓶的是
X气体 | Y试剂 | Z试剂 | |
A | NO2 | H2O | H2O |
B | HCl | H2O | H2O |
C | HCl和O2混合气体 | H2O | H2O |
D | NH3和N2混合气体 | H2O | H2O |

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19 g·cm-3
HCl的质量分数:36.5%
(1)该浓盐酸中HCl的物质的量浓度为__________mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是________。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取________mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面(____)
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水(____)
(4)①假设该同学成功配制了0.400 mol·L-1的盐酸,他又用该盐酸中和含0.4 g NaOH的NaOH溶液,则该同学需取________mL盐酸。
②假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是________。
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023
B. 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7
C. 钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀
D. 一定条件下反应N2+3H22NH3达到平衡时,3v正(H2)=2v逆(NH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳捕捉技术”常用于去除或分离气流中的二氧化碳。
Ⅰ.2017年,中国科学家在利用二氧化碳直接制备液体燃料领域取得了突破性进展,其中用二氧化碳制备甲醇(CH3OH)的反应如下图:
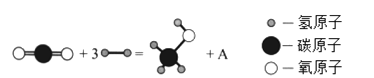
(1)A的化学式为_________。
(2)该反应说明CO2具有___________性(填“氧化”或“还原”)。若有1mol甲醇生成,转移电子的物质的量为_________________mol。
Ⅱ.利用NaOH溶液“捕提"CO2的基本过程如下图(部分条件及物质已略去):
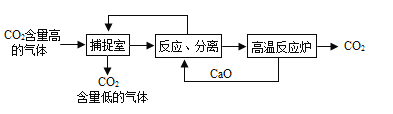
(1)反应分离室中,发生反应的化学方程式分别为CaO+H2O=Ca(OH)2和__________________
(2)高温反应炉中,涉及反应的化学反应类型为_______________________。
(3)整个过程中,可以循环利用物质的化学式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com