
【题目】下列物质中,不属于电解质的是( )
A.NaOH
B.H2SO4
C.蔗糖
D.KCl
科目:高中化学 来源: 题型:
【题目】分类、归纳等是化学学习常用方法。下列分类、归纳正确的是
A.氧化物:SO2、HClOB.复合肥料:KNO3、CO(NH2)2
C.人体必需微量元素:Ca、SeD.有机物:C6H12O6、CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半导体材料磷化硼(BP)可由BBr3和PBr3在高温下合成。回答下列问题:
(1)在现代化学中,常利用______________(填“原子光谱”或“分子光谱”) 上的特征谱线来鉴定元素,称为光谱分析。
(2)基态P原子的价电子排布式为_______,同周期中第一电离能比P小的元素有_______种。
(3)在水中的溶解度BBr3_________PBr3(填“>”或“<”),原因是____________________。
(4)一定温度下PBr5能形成阴、阳离子个数比为1:1的导电熔体,阴阳离子均带一个电位电荷,经测定其中P-Br键键长均相等。写出该导电熔体中阳离子的电子式:_____________,其中P原子的杂化轨道类型是_____________________。
(5)已知磷化硼晶体中P原子作面心立方最密堆积,若某个P的原子坐标为(0,0,0),则晶胞中其余P原子的坐标为______________ (写出一个即可),B原子填入四面体空隙中,B的原子坐标分别为(![]() ,
,![]() ,
,![]() )、(
)、(![]() ,
,![]() ,
,![]() )、(
)、(![]() ,
,![]() ,
,![]() )、(
)、(![]() ,
,![]() ,
,![]() ),相邻P原子和B原子核间距为dcm,则该晶体中每个B原子周围有______个B原子与它距离最近,晶体密度为________g·cm-3 (NA表示阿 伏加德罗常数的值)。
),相邻P原子和B原子核间距为dcm,则该晶体中每个B原子周围有______个B原子与它距离最近,晶体密度为________g·cm-3 (NA表示阿 伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652 kJ的热量。
(1)该反应的热化学方程式为__________________________。
(2)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/(kJ/mol) | a | b | c | x |
已知白磷的燃烧热ΔH=-d kJ/mol,白磷及其完全燃烧的产物结构如下图所示,则上表中x=______________________(用含有a、b、c、d的代数式表示)。

(II)分别取40 mL的0.50 mol/L盐酸与0.55 mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。

请回答下列问题:
(3)A的仪器名称为_____________。
(4)如下图所示,泡沫塑料板上面有两个小孔,两个小孔不能开得过大,其原因是____________;反应需要测量温度,每次测量温度后都必须采取的操作是____________________。
(5)某学生实验记录数据如下:
实验序号 | 起始温度t1 ℃ | 终止温度t2 ℃ | |
盐酸 | 氢氧化钠 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
已知盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c=4.18 J/(g·℃)
依据该学生的实验数据计算,该实验测得的中和热ΔH=________;
(6)假定该学生的操作完全同上,实验中改用100 mL 0.5 mol/L盐酸跟100 mL 0.55 mol/L氢氧化钠溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d为短周期元素,原子序数依次增大。25℃时,其最高价氧化物的水化物溶液(浓度均为0.1mol·L-1)的pH和原子序数的关系如图所示。下列有关说法正确的是

A. 简单离子半径:b>a
B. d元素氧化物的水化物一定是强酸
C. 气态氢化物的稳定性:d>c
D. b、c的简单离子都能破坏水的电离平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素周期系的叙述正确的是 ( )
A. 元素周期系中ⅠA族元素又称为碱金属元素
B. 元素周期系中每一周期元素的种类均相等
C. 元素周期系的形成原因是核外电子排布的周期性变化
D. 每一周期的元素最外层电子数均是1→8,周而复始
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。工业上常采用催化还原法和碱吸收法处理SO2气体。

(1)下图所示:1mol CH4完全燃烧生成气态水的能量变化和1mol S(g)燃烧的能量变化。在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式________________________________________________________。
(2)焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g)![]() S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示:
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示:
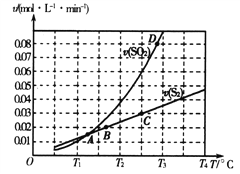
①A、B、C、D四点对应的状态中,达到平衡状态的有_____________(填字母)。
②该反应的△H_____0(填“>”“<”或“=”)。
③下列措施能够增大SO2平衡转化率的是______________。
A.降低温度 B.增加C的量 C.减小容器体积 D.添加高效催化剂
(3)用氨水吸收SO2。25℃时2.0mol·L-1的氨水中,NH3·H2O的电离度α=______(![]() ×100%)。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的
×100%)。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的![]() =_______。(已知25℃,Kb(NH3·H2O)=1.8×10-5;Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8)
=_______。(已知25℃,Kb(NH3·H2O)=1.8×10-5;Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8)
(4)当吸收液失去吸收能力后通入O2可得到NH4HSO4溶液,用如图所示装置电解所得NH4HSO4溶液可制得强氧化剂(NH4)2S2O8

①写出电解NH4HSO4溶液的化学方程式____________。
②若用9.65A的恒定电流电解饱和NH4HSO4溶液1小时,理论上生成的(NH4)2S2O8的物质的量为________。(F=96500C·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述错误的是
A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 如图所示实验可证明元素的非金属性:Cl>C>Si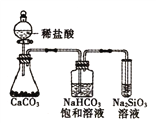
C. 若X-和Y2-的核外电子层结构相同,则原子序数:X>Y
D. 在周期表中金属与非金属分界处的锗是一种优良的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能大量共存的离子组是( )
A.Na+、Ag+、NO3-、Cl-B.Cu2+、Na+、H+、OH-
C.K+、Ba2+、CO32-、Cl-D.K+、Na+、CO32-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com