
海洋约占地球表面积的71%,海水中化学资源的利用具有非常广阔的前景。
(1)目前世界上60%的镁是从海水中提取的,其主要步骤如下:
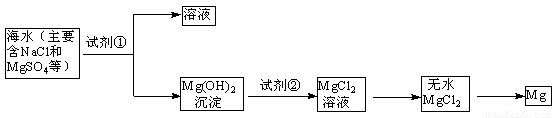
① 试剂①宜选用石灰乳且必须过量,过量的目的是 .
② 镁蒸气宜在 (填序号)气体冷却后得到镁锭(A. N2 B. CO2 C. Ar D. 空气)
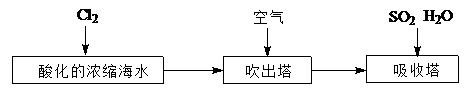
(2)工业以浓缩海水为原料提取溴的部分过程如下:
某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):
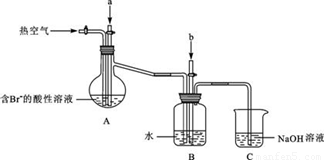
③A装置中通入a气体时,反应的离子方程式表示为: .
④A装置中通入a气体一段时间后,
停止通入,改通热空气。通入热空气的目的是: .
⑤反应过程中,B装置中产生的两种主要阴离子为 .
⑥C装置的作用是 。
①使Mg2+完全转化为Mg(OH)2沉淀 ②C ③Cl2+2Br-=2 Cl-+Br2
④将溴从蒸馏烧瓶A中吹出 ⑤SO42-、Br-
⑥吸收未反应完的Cl2、Br2、SO2等有毒气体,防止污染空气
【解析】
试题分析:(1)①过量的石灰乳能使Mg2+完全转化为Mg(OH)2沉淀,故答案为:使Mg2+完全转化为Mg(OH)2沉淀;②镁是活泼的金属,能和氧气、氮气以及CO2反应,所以应该在Ar中冷却,故答案为:C;(2)③a气体应该是氯气,能把溴离子氧化生成单质溴,反应的离子方程式是Cl2+2Br-=2Cl-+Br2,故答案为:Cl2+2Br-=2Cl-+Br2;④通入热空气能将溴从蒸馏烧瓶A中吹出,提高产量,故答案为:将溴从蒸馏烧瓶A中吹出;⑤b气体是SO2,溴水能把SO2氧化生成溴化氢和硫酸,所以B装置中产生的两种主要阴离子为SO42-、Br-,故答案为:SO42-、Br-;⑥氢氧化钠能吸收未反应完的Cl2、Br2、SO2等有毒气体,防止污染空气,故答案为:吸收未反应完的Cl2、Br2、SO2等有毒气体,防止污染空气。
考点:本题考查海水的综合应用、离子方程式的书写、尾气处理


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:阅读理解

| 催化剂 |

| 催化剂 |


| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| △ |
| ||
| 2800℃ |
| △ |
| ||
| 还原 |
| HCl |
| ||
| 714℃ |
| HCl |
| ||
| 还原 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| △ |
| 电解 |
| 2800℃ |
| △ |
| C |
| 还原 |
| HCl |
| ||
| 714℃ |
| HCl |
| 活泼金属 |
| 还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
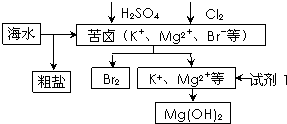
| A、可用BaCl2溶液除去粗盐中的SO42- | B、从苦卤中提取Br2的反应的离子方程式为:2Br-+Cl2═2Cl-+Br2 | C、试剂1可以选用石灰乳 | D、工业上,电解熔融MgO冶炼金属镁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com