
分析 (1)H++OH-═H2O表示强酸与强碱反应生成可溶性盐与水的离子反应;
(2)Al2(SO4)3为强电解质,水溶液中完全电离;
(3)少量二氧化碳生成碳酸钡和水,过量二氧化碳生成碳酸氢钡;
(4)⑥与过量的碳酸氢钠溶液反应生成碳酸钡、碳酸钠和水;
(5)Al元素的化合价由0升高为+3价,以此计算转移电子数.
解答 解:(1)上述十种物质中有两种物质之间可发生离子反应:H++OH-=H2O,说明是强酸强碱反应生成溶于水的盐的离子反应,氢氧化钡和稀硝酸反应符合,该离子反应对应的化学方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;
故答案为:Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;
(2)Al2(SO4)3属于盐是强电解质,水溶液中完全电离,电离方程式为:Al2(SO4)3=2Al3++3SO42-,故答案为:Al2(SO4)3=2Al3++3SO42-;
(3)少量的④通入⑥的溶液中反应,是二氧化碳通入氢氧化钡溶液中反应生成碳酸钡沉淀和水,反应的离子方程式为CO2+Ba2++2OH-=BaCO3↓+H2O;过量的④通入⑥的溶液中反应的离子方程式为CO2+OH-=HCO3-,
故答案为;CO2+Ba2++2OH-=BaCO3↓+H2O;CO2+OH-=HCO3-;
(4)⑥与过量的碳酸氢钠溶液反应生成碳酸钡、碳酸钠和水,离子反应为Ba2++2OH+2HCO3-=2H2O+BaCO3↓+CO32-,
故答案为:Ba2++2OH+2HCO3-=2H2O+BaCO3↓+CO32-;
(5)②与⑨发生反应的化学方程式为:Al+4HNO3=Al(NO3)3+NO↑+2H2O,当有5.4g Al物质的量=$\frac{5.4g}{27g/mol}$=0.2mol,电子转移为0.2mol×(3-0)=0.6mol,电子数为0.6NA或3.612×1023,故答案为:0.6NA或3.612×1023.
点评 本题考查较综合,涉及离子反应方程式书写、氧化还原反应转移电子的计算等,注重高频考点的考查,把握离子反应的书写方法、反应中元素的化合价变化为解答的关键,综合性较强,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸常显黄色的原因是浓硝酸中溶有少量NO2 | |
| B. | 氯水和二氧化硫都能使品红溶液褪色 | |
| C. | 漂白粉长期暴露在空气中会变质 | |
| D. | 蔗糖中加入浓硫酸固体颜色变黑,说明浓硫酸具有吸水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
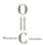 .根据上述信息,回答下列问题:
.根据上述信息,回答下列问题: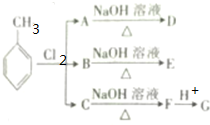
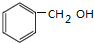 .
.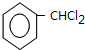 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$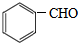 +2NaCl+H2O.
+2NaCl+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (A-N+3)mol | B. | $\frac{n}{A+106.5}$(A-N+51)mol | ||
| C. | $\frac{n}{A+35.5}$(A-N+51)mol | D. | $\frac{n}{A+106.5}$(A-N+47)mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com