
����Ŀ����¯���������з�������Ҫ��ӦΪ1/3Fe2O3(s)+CO(g) ![]() 2/3Fe(s)+CO2(g)
2/3Fe(s)+CO2(g)
��֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����£�
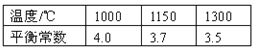
��ش��������⣺
��1���÷�Ӧ��ƽ�ⳣ������ʽK= �����������¶����ߣ�ƽ�ⳣ����С����������Ӧ�� �ȷ�Ӧ��������š�����
��2������߷�Ӧ��CO��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�� ��
A������Fe����
B������Fe2O3����
C���Ƴ�����CO2
D��������ʵĴ���
E�������������ݻ�
��3����һ���ݻ�Ϊ1L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��2.0mol����Ӧ����5min��ﵽƽ�⡣���ʱ�䷶Χ�ڷ�Ӧ��ƽ����Ӧ���ʣ�v (CO2)= ��CO��ƽ��ת����= ����Ҫ��д������̣�
���𰸡���1��c(CO2)/c(CO)���ţ���2��C
��3����COת�������ʵ���Ϊx����
1/3Fe2O3��s��+CO��g���T2/3Fe��s��+CO2��g��
��ʼ����mol�� 2.0 2.0
ת��������mol�� x x
ƽ��ʱ������mol�� 2.0��x 2.0+x
����1000��ʱK=4.0������(2.0+x)/(2.0��x)=4.0�����x=1.2��
CO2��Ũ�ȱ仯��Ϊ��c(CO2)=1.2mol��L��1��
���ö�����̼��ʾ�ķ�Ӧ����Ϊ1.2mol��L��1/5min=0.24mol��(L��min)��1
CO��ת����Ϊ1.2 mol/2 mol��100%=60%
��������
�����������1���÷�Ӧ��ƽ�ⳣ������ʽK=c(CO2)/c(CO) ���¶����ߣ�ƽ�ⳣ����С��˵����Ӧ�����ƶ�����÷�ӦΪ���ȷ�Ӧ��
��2��A��Fe�ǹ��壬�ı������ƽ�ⲻ�ƶ���CO��ƽ��ת�������䣬A����B��Fe2O3�ǹ��壬�ı������ƽ�ⲻ�ƶ���CO��ƽ��ת�������䣬B����C���Ƴ�����CO2��ƽ�������ƶ���CO��ƽ��ת��������C��ȷ��D��������ʵĴ�����ƽ�ⲻ�ƶ���D����E���÷�ӦΪǰ������ϵ������ķ�Ӧ�������������ݻ���ƽ�ⲻ�ƶ���CO��ƽ��ת�������䣬E����ѡC��
��3����COת�������ʵ���Ϊx����
1/3Fe2O3��s��+CO��g���T2/3Fe��s��+CO2��g��
��ʼ����mol�� 2.0 2.0
ת��������mol�� x x
ƽ��ʱ������mol�� 2.0��x 2.0+x
����1000��ʱK=4.0������(2.0+x)/(2.0��x) =4.0�����x=1.2��
CO2��Ũ�ȱ仯��Ϊ��c(CO2)= 1.2 mol��L��1��
���ö�����̼��ʾ�ķ�Ӧ����Ϊ1.2 mol��L��1/5 min =0.24 mol��(L��min )��1
CO��ת����Ϊ1.2 mol/2 mol��100%=60%


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���ij�̶��ݻ����ܱ������м���1molCO(g)��1molH2O(g)���������·�Ӧ��CO(g)+H2O(g)![]() CO2(g)+H2(g)���˷�Ӧ�ﵽƽ��ı�־��( )
CO2(g)+H2(g)���˷�Ӧ�ﵽƽ��ı�־��( )
A����ϵ����ѹǿ����
B����ϵ�ڸ����ʵ������������ٷ����仯
C����ϵ�������ܶȲ��ٷ����仯
D����λʱ������0.1molCO(g)��ͬʱ����0.1molH2O(g)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[�л���ѧ����] �л���H��һ����Ҫ��ҽҩ�м��塣��ṹ��ʽ��ͼ��ʾ��
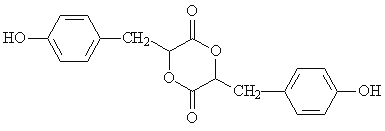
�ϳ�H��һ��·�����£�
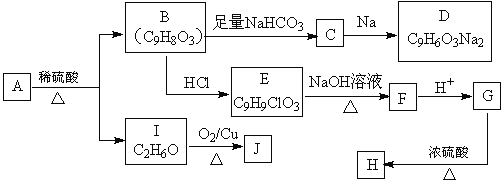
��֪������Ϣ��
���л���A���Ȼ�����Һ������ɫ��Ӧ��������еı�������2��ȡ��������A�ı�����һ�ȴ�����2�֡� ��J�ܷ���������Ӧ��
��ش��������⣺
��1��I�������� ��G����H�ķ�Ӧ������ ��
��2��B�ĺ��������������� ��E����F�Ļ�ѧ����ʽΪ ��
��3����һ�������£�A��J�����ʵ�����1��1��Ӧ���ɹ��ܸ߷��Ӳ���K��K�Ľṹ��ʽΪ ��
��4����֪��![]() ��C��E�����ʵ�����1��1����ڴ��������������·�Ӧ��д����ѧ����ʽ ��
��C��E�����ʵ�����1��1����ڴ��������������·�Ӧ��д����ѧ����ʽ ��
��5��L��B��ͬ���칹�壬L�������������Ľṹ�� �֣�����������ṹ����
����B������ͬ�Ĺ����ţ������Ȼ�����Һ������ɫ��Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������3���л�������A�� CH2=CH-CH3B��![]() C��CH3CH2OH
C��CH3CH2OH
��1��д��������A��C�еĹ����ŵ����� �� ��
��2��A�ڴ����������������ɾۺ���ķ�Ӧ����ʽΪ ��
��3�� B���Ա����Ը�����������ɱ����ᣬд����������C������Ũ�����й��ȷ���������Ӧ�Ļ�ѧ����ʽ�� ��
��4�� ���ᣨ�Ҷ��ᣩ���Ҷ�����1:1���ɾ��Ҷ����Ҷ����ķ�Ӧ����ʽΪ__________��
��5�� ��������ͨ�������̼�ķ�Ӧ����ʽΪ__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ij������A��ͬ��ͬѹ���������ܶ���H2��43��, ������ķ���ʽ ��
��2��ij����B����16�����ۼ����������ͬ���칹���� ����
��3��ij����C�Ľṹ��ʽΪCH3CH2CH(CH3)2���������һ��ȡ������ ����
��4��ij��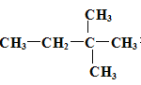 ����һ����Dͨ���ӳɷ�Ӧ���Ƶã�����D�Ŀ��ܵ��� ����дһ�ֿ��ܵĽṹ��ʽ����
����һ����Dͨ���ӳɷ�Ӧ���Ƶã�����D�Ŀ��ܵ��� ����дһ�ֿ��ܵĽṹ��ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ-ѡ��2����ѧ�뼼����
������ͭ(CuCl)�㷺Ӧ���ڻ�����ӡȾ����Ƶ���ҵ��CuCl�����ڴ���ˮ��������������Ũ�Ƚϴ����ϵ���ڳ�ʪ��������ˮ���������Ժ���ͭ(��Ҫ�ɷ���Cu������CuO)Ϊԭ�ϲ�������������ֽ⼼������CuC1�Ĺ��չ������£�
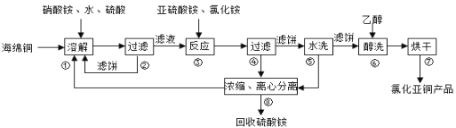
�ش��������⣺
��1���������еõ�������������___________���ܽ��¶�Ӧ������60-70����ԭ����___________��
��2��д������������Ҫ��Ӧ�����ӷ���ʽ_________________��
��3��������������pH=2����ϴ��ˮϴ������������ϴ���õ�����__________(д����)��
��4�����������У�����������ʡ�ԣ�������_________________��
��5����������������������Ҫ���й�Һ���룮��ҵ�ϳ��õĹ�Һ�����豸��_______(����ĸ)
A�������� B�����Ļ� C����Ӧ�� D����ʽѹ�˻�
��6��ȷ��ȡ���Ʊ����Ȼ���ͭ��Ʒmg���������ڹ�����FeCl3��Һ�У�����Ʒ��ȫ�ܽ��������ϡ���ᣬ��amol/L-1��K2Cr2O7��Һ�ζ����յ㣬����K2Cr2O7��ҺbmL����Ӧ��Cr2O72-����ԭΪCr3+����Ʒ��CuCl����������Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ���о�̼�����ϡ���ᷴӦ�ķ�Ӧ���ʣ�һλͬѧͨ��ʵ��ⶨ��Ӧ�����ɵ�CO2��������淴Ӧʱ��仯��������������ߣ��������������������
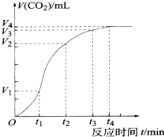
��1��̼�����ϡ����ķ�Ӧ�Ƿ��ȷ�Ӧ���������ڷ�Ӧ��������� ������ڡ���С�ڡ������������������
��2����0��t1��t1��t2��t2��t3��t3��t4����ͬ��ʱ�����ռ������������� ʱ�������Ӧ���������� ʱ��Σ���Ӧ������С���� ʱ�����
��3��t1��t2ʱ�����Ӱ�췴Ӧ���ʵ���Ҫ������� ��t2��t3ʱ�����Ӱ�췴Ӧ���ʵ���Ҫ��������� ����¶ȡ���Ũ�ȡ���ѹǿ���������������ѣ�����÷֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ�����ͼ���������б�Ҫ�����Ӳ���գ�

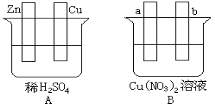
��1����Aͼ�У�ʹͭƬ��ðH2���ݡ���װ�ü������ӣ������Ӻ��װ�ý� ��
�缫��Ӧʽ��п�壺 ��ͭ�壺 ��
��2����Bͼ�У�a��b���缫��Ϊʯī����װ�ü������ӣ�ʹa������ͭ����b���� ����װ�ý� ���缫��Ӧʽ��a���� b���� ������һ��ʱ���ֹͣ��Ӧ��������Һ����Һ��pHֵ �����ߡ����͡����䣩������һ������ ���ѧʽ������Һ�ָܻ�������ǰ��ȫһ�¡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ����Ҫ�ɷ�ΪCuFeS2 ��SΪ-2�ۣ��ǹ�ҵ��ͭ����Ҫԭ�ϣ�����һ����Ȼ��ͭ��SiO2����Ϊ�˲ⶨ�û�ͭ��Ĵ��ȣ����������ʵ�飺
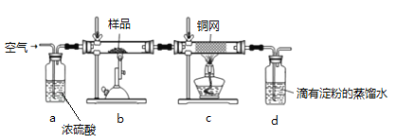
�ֳ�ȡ��ϸ�Ļ�ͭ����Ʒ1.84g���ڿ��������½������գ��������·�Ӧ��![]()
ʵ���ȡd����Һ��![]() ������ƿ�У���0.0500mol/L������Һ���еζ������ı���Һ20.00mL����ش��������⣺
������ƿ�У���0.0500mol/L������Һ���еζ������ı���Һ20.00mL����ش��������⣺
��1�������������� ��������0.3molSO2����ʱ��ת�Ƶ��� mol��
��2������Ʒ��ϸ���ٷ�Ӧ����Ŀ���� ��װ��c�������� ��
��3���ñ�����Һ�ζ�d����Һ�����ӷ���ʽ�� ���ζ����յ�ʱ�������� ��
��4��������Ӧ����������ͨһ��ʱ��Ŀ�������Ŀ���� ��
��5��ͨ�������֪���û�ͭ��Ĵ���Ϊ ��
��6������ԭװ��d�е���Һ��ΪBa(OH)2��Һ����û�ͭ��ƫ�ߣ�����ʵ���������ȷ�����ܵ�ԭ����Ҫ�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com