
【题目】亚硝酰氯(ClNO)常用于合成洗涤剂、触媒及用作中间体,某学习小组在实验室用Cl2与NO制备ClNO并测定其纯度,进行如下实验(夹持装置略去)。

查阅资料:亚硝酰氯(ClNO)的熔点为-64.5℃、沸点为-5.5℃,气态呈黄色,液态时呈红褐色,遇水易反应生成一种氯化物和两种氮的常见氧化物,其中一种呈红棕色。
请回答下列问题:
Ⅰ.Cl2的制备:舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。
(1)该方法可以选择上图中的______(填字母标号)为Cl2发生装置,该反应中被氧化与被还原物质的物质的量之比为______。
(2)欲收集一瓶纯净干燥的氯气,选择上图中的装置,其连接顺序为:a→______→i→h(按气流方向填小写字母标号)。
Ⅱ.亚硝酰氯(ClNO)的制备、实验室可用下图装置制备亚硝酰氯(ClNO):

(3)实验室也可用B装置制备NO,与B装置相比,使用X 装置的优点为______。
(4)组装好实验装置后应先______,然后装入药品。一段时间后,两种气体在Z中反应的现象为______。
III.亚硝酰氯(ClNO)纯度的测定:将所得亚硝酰氯(ClNO)产品13.10 g溶于水,配制成250 mL溶液;取出25.00 mL,以K2CrO4溶液为指示剂,用0.8 mol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为 22.50 mL。(已知:Ag2CrO4为砖红色固体)
(5)亚硝酰氯(ClNO)与水反应的离子方程式为______。
(6)亚硝酰氯(ClNO)的质量分数为______。(保留两位有效数字)
【答案】 C 2∶1 g→f→e→d→c→b 排除装置内空气的干扰,可以随开随用,随关随停 检查装置的气密性 出现红褐色液体 2ClNO + H2O == 2H+ + 2Cl- + NO↑+ NO2↑ 90%
【解析】(1)实验室制取氯气的方法是将二氧化锰固体与浓盐酸混合加热,所以选取的装置为C。该反应中有2mol HCl被氧化为1mol Cl2,有1mol MnO2被还原为Mn2+,所以被氧化与被还原物质的物质的量之比为2:1。
(2)制取的氯气应该先过饱和食盐水除去氯化氢,过浓硫酸干燥,再收集(氯气密度大于空气,应该长进短出),所以顺序为:a→g→f→e→d→c→b→i→h。
(3)X可以从U形管的左侧加入硝酸,当硝酸没过铜丝的时候,可以保证装置内没有空气,这样生成的NO比较纯净。当反应需要停止时,可以关闭K1,此时NO气体无法排出,会产生一定气压,使U形管右侧液面下降,当固液分离的时候,反应自动停止。由上,X装置的优点是:排除装置内空气的干扰,可以随开随用,随关随停。
(4)实验的一般步骤是连接装置再检查气密性,再进行实验。一段时间后,两种气体在Z中反应生成亚硝酰氯,而亚硝酰氯是一种红褐色液体,所以现象为Z的三颈瓶中出现红褐色液体。
(5)亚硝酰氯遇水易反应生成一种氯化物(只能是HCl)和两种氮的常见氧化物(NO和NO2),所以反应的离子方程式为:2ClNO + H2O == 2H+ + 2Cl- + NO↑+ NO2↑。
(6)加入的硝酸银为0.8×22.5×10-3=0.018mol,所以氯离子为0.018mol,根据Cl守恒得到ClNO为0.018mol,考虑到题目是将产品配成250mL溶液,取25mL进行滴定,所以含有的ClNO为0.18mol,质量为0.18×65.5=11.79g,质量分数为11.79÷13.1=90%。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】某化学学习小组设计了如下从海带灼烧后的海带灰中提取碘单质的流程:
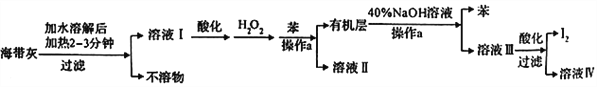
(1)溶解海带灰时要加热煮沸2~3min的目的是_________,操作a的名称是 _______。
(2)向酸化的溶液I中加入H2O2的目的是__________________________________。
(3)已知I2与40%的NaOH溶液反应生成的氧化产物和还原产物的物质的量之比为1:5,则发生反应的化学方程式是________________________________。
(4)最后过滤得到的I2需要进行洗涤和干燥,下列洗涤剂中最应该选用的是______。
a.热水 b.乙醇 c.冷水 d.二硫化碳
(5)用Na2S2O3的标准溶液测定产品的纯度,发生反应:I2+2Na2S2O3=Na2S4O6+2NaI。取5.0g产品,配制成100ml溶液。取10.00ml溶液,以淀粉溶液为指示剂,用浓度为0.050mol·L-1Na2S2O3的标准溶液进行滴定,相关数据记录如下表所示。
编号 | 1 | 2 | 3 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 |
消耗Na2S2O3标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
滴定时,达到滴定终点的现象是________,碘单质在产品中的质量分数是________% 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:
![]()
![]()
![]() ―→
―→![]() ―→
―→![]()
粗盐中含Ca2+、Mg2+、Fe3+、SO![]() 等杂质,提纯的步骤有:
等杂质,提纯的步骤有:
①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③加入过量的NaOH溶液 ④加入适量盐酸 ⑤溶解 ⑥过滤 ⑦蒸发,其正确的操作顺序是( )
A. ⑤②③①⑥④⑦ B. ⑤①②③⑥④⑦
C. ⑤②①③④⑥⑦ D. ⑤③①②⑥④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑下列说法正确的是( )
A. KNO3是还原剂,其中氮元素被氧化
B. 生成物中的N2是氧化产物,K2O是还原产物
C. 每转移1 mol电子,可生成N2的体积为35.84 L
D. 若有65 g NaN3参加反应,则被氧化的N的物质的量为3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子浓度变化如图所示,下列有关说法正确的是( )

A.常温下,PbI2的Ksp为2×10-6
B.温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的溶解度不变,Pb2+浓度不变
C.T时刻改变的条件是升高温度,因而PbI2的Ksp增大
D.常温下Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液, PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)反应的化学平衡常数为5×1018
PbS(s)+2I-(aq)反应的化学平衡常数为5×1018
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素a、b、c、d、e 的原子序数依次增大,由它们形成的化合物X、Y、Z、W 在一定条件下的相互转化关系如图所示。已知X、Y、Z均含有d元素;X的焰色反应呈黄色;Y是两性氢氧化物;0.1mol·L-1W溶液的pH为1。下列说法正确的是
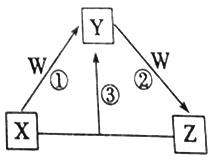
A. e元素的含氧酸的酸性在同主族中最强
B. b元素的单质和氢化物可能具有氧化性和漂白性
C. c与e和a与e元素形成的化合物均属于电解质且化学键类型相同
D. b、c、d元素的离子半径大小顺序是b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com