
【题目】下列氯化物中,既能由金属和氯气直接化合制得,又能由金属和盐酸反应制得的是( )
A.CuCl2
B.FeCl2
C.FeCl3
D.NaCl
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑下列说法正确的是( )
A. KNO3是还原剂,其中氮元素被氧化
B. 生成物中的N2是氧化产物,K2O是还原产物
C. 每转移1 mol电子,可生成N2的体积为35.84 L
D. 若有65 g NaN3参加反应,则被氧化的N的物质的量为3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,用水稀释0.1 mol/L的醋酸溶液,随加水量的增加而增大的是( )
A.n(CH3COOH) B.c(H+) C. c(H+) ·c(OH-) D. c(H+)/c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】英国曼彻斯特大学科学家安德烈·海姆和康斯坦丁·诺沃肖洛夫。共同工作多年的二人因“突破性地”用撕裂的方法从石墨中成功获得超薄材料石墨烯而获奖。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型示意图如图:
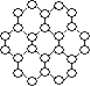
(1)下列有关石墨烯说法正确的是______。
a.12 g石墨烯含![]() 键数为NA
键数为NA
b.石墨烯分子中所有原子可以处于同一平面
c.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
d.石墨烯中每个C原子连接3个六元环,每个六元环占有6个C原子
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①基态铜原子能量最高的电子占据的能级符号是_____;第四周期元素中,最外层电子数与铜相同的元素还有______。
②下列分子属于非极性分子的是______。
a.甲烷 b.二氯甲烷 c.苯 d.乙醇
③乙醇的沸点要高于相对分子质量比它还高的丁烷,请解释原因______。
④酞菁与酞菁铜染料分子结构如下图1,酞菁分子中碳原子采用的杂化方式是______。

⑤金与铜可形成的金属互化物合金(如上图2),它的化学式可表示为______;在Au周围最近并距离相等的Cu有______个,若2个Cu原子核的最小距离为d pm,该晶体的密度可以表示为______g/cm3。(阿伏加德罗常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)常用于合成洗涤剂、触媒及用作中间体,某学习小组在实验室用Cl2与NO制备ClNO并测定其纯度,进行如下实验(夹持装置略去)。

查阅资料:亚硝酰氯(ClNO)的熔点为-64.5℃、沸点为-5.5℃,气态呈黄色,液态时呈红褐色,遇水易反应生成一种氯化物和两种氮的常见氧化物,其中一种呈红棕色。
请回答下列问题:
Ⅰ.Cl2的制备:舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。
(1)该方法可以选择上图中的______(填字母标号)为Cl2发生装置,该反应中被氧化与被还原物质的物质的量之比为______。
(2)欲收集一瓶纯净干燥的氯气,选择上图中的装置,其连接顺序为:a→______→i→h(按气流方向填小写字母标号)。
Ⅱ.亚硝酰氯(ClNO)的制备、实验室可用下图装置制备亚硝酰氯(ClNO):

(3)实验室也可用B装置制备NO,与B装置相比,使用X 装置的优点为______。
(4)组装好实验装置后应先______,然后装入药品。一段时间后,两种气体在Z中反应的现象为______。
III.亚硝酰氯(ClNO)纯度的测定:将所得亚硝酰氯(ClNO)产品13.10 g溶于水,配制成250 mL溶液;取出25.00 mL,以K2CrO4溶液为指示剂,用0.8 mol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为 22.50 mL。(已知:Ag2CrO4为砖红色固体)
(5)亚硝酰氯(ClNO)与水反应的离子方程式为______。
(6)亚硝酰氯(ClNO)的质量分数为______。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法中正确的是
A. 冰在室温下自动熔化成水,是熵增的重要结果
B. 高锰酸钾加热分解是一个熵减小的过程
C. △H<0的反应均是自发反应
D. △S为负值的反应均不能自发进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com