
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:X2(g) + 3Y2(g) 2XY3(g) △H=-92.6 kJ.mol-1
2XY3(g) △H=-92.6 kJ.mol-1
容器 编号 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系能量的变化 | ||
X2 | Y2 | XY3 | |||
① | 1 | 3 | 0 | 2分钟 | 放热46.3kJ |
② | 0.4 | 1.2 | 1.2 | / | Q(Q>0) |
实验测得反应在起始、达到平衡时的有关数据如下表所示,下列叙述不正确的是
A.容器①中反应达平衡时用XY3表示的反应速率为v(XY3)=1/30moI.L-l·s-1
B.平衡时,两个容器中XY3的物质的量浓度相等
C.容器②中反应达到平衡时吸收的热量为Q
D.若容器①体积为0.3L,则达平衡时放出的热量大于46.3kJ
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源:2014-2015河北枣强中学高二上学期期末考试化学试卷(解析版) 题型:选择题
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O===O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
查看答案和解析>>
科目:高中化学 来源:2014-2015河北唐山市高一下学期开学调研考试化学试卷(解析版) 题型:选择题
下图所示是验证氯气性质的微型实验,a、b、c、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
已知:2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O

对实验现象的“解释或结论”正确的是
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+ > Cl- |
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省唐山市高二下学期开学调研化学试卷(解析版) 题型:选择题
高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述正确的是
A.放电时,负极反应式为3Zn-6e-+6OH-===3Zn(OH)2
B.放电时,正极区溶液的pH减小
C.充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原
D.充电时,电池的锌电极接电源的正极
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省唐山市高二下学期开学调研化学试卷(解析版) 题型:选择题
某同学为完成 2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验如图所示你认为可行的是
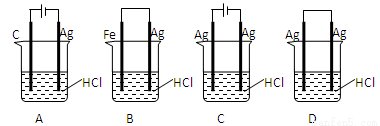
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省唐山市高二下学期开学调研化学试卷(解析版) 题型:选择题
下列关于水的电离不正确的是
A.加酸或碱一定抑制水的电离
B.加盐一定促进水的电离
C.升高温度,水的pH值变小
D.常温下任何稀的酸、碱、盐水溶液中KW=10-14
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市河东区高三一模理综化学试卷(解析版) 题型:简答题
(14分)目前“低碳经济”备受关注。CO2的产生及有效开发利用成为科学家研究的重要课题。试利用所学知识,解决下列问题。
目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题.试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: 它所对应的化学反应为:_________________
它所对应的化学反应为:_________________
(2)一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生(1)中反应:其相关数据如表所示:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需的时间/min | |
C(s) | H2O(g) | H2(g) | ||||
甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
①T1℃时,该反应的平衡常数K=
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度 (填选项字母).
A.=0.8molL﹣1 B.=1.4molL﹣1
C.<1.4molL﹣1 D.>1.4molL﹣1
③丙容器的容积为1L,T1℃时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g),达到平衡时各气体的体积分数与甲容器完全相同的是 (填选项字母).
A.0.6mol、1.0mol、0.5mol、1.0mol
B.0.6mol、2.0mol、0mol、0mol
C.1.0mol、2.0mol、1.0mol、2.0mol
D.0.25mol、0.5mol、0.75mol、1.5mol
(3)将燃煤废气中的CO2转化为甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
投料比[ | 500K | 600K | 700K | 800K |
1.5 | 45% | 33% | 20% | 12% |
2.0 | 60% | 43% | 28% | 15% |
3.0 | 83% | 62% | 37% | 22% |
①该反应的焓变△H 0,熵变△S 0(填>、<或=).
②用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 .若以1.12Lmin﹣1(标准状况)的速率向该电池中通入甲醚(沸点为﹣24.9℃),用该电池电解500mL 2molL﹣1 CuSO4溶液,通电0.50min后,理论上可析出金属铜 g.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三“二诊”考试化学试卷(解析版) 题型:选择题
下列有关能量的叙述不正确的是
A.活化能的大小对化学反应前后的能量变化不产生影响
B.化学键的断裂和形成是物质在化学变化中发生能量变化的主要原因
C.盐酸和NaOH(aq)反应的中和热△H=-57.3kJ/mol,则H2SO4(aq)和Ca(OH)2(aq)反应的中和热△H=2×(-57.3)kJ/mol
D.CO(g)的燃烧热是283.0kJ/mol,则反应2CO2(g)=2CO(g)+O2(g)的反应热△H= +2×283.0kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com