
下列有关能量的叙述不正确的是
A.活化能的大小对化学反应前后的能量变化不产生影响
B.化学键的断裂和形成是物质在化学变化中发生能量变化的主要原因
C.盐酸和NaOH(aq)反应的中和热△H=-57.3kJ/mol,则H2SO4(aq)和Ca(OH)2(aq)反应的中和热△H=2×(-57.3)kJ/mol
D.CO(g)的燃烧热是283.0kJ/mol,则反应2CO2(g)=2CO(g)+O2(g)的反应热△H= +2×283.0kJ/mol
科目:高中化学 来源:2014-2015河北省唐山市高二下学期开学调研化学试卷(解析版) 题型:选择题
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:X2(g) + 3Y2(g) 2XY3(g) △H=-92.6 kJ.mol-1
2XY3(g) △H=-92.6 kJ.mol-1
容器 编号 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系能量的变化 | ||
X2 | Y2 | XY3 | |||
① | 1 | 3 | 0 | 2分钟 | 放热46.3kJ |
② | 0.4 | 1.2 | 1.2 | / | Q(Q>0) |
实验测得反应在起始、达到平衡时的有关数据如下表所示,下列叙述不正确的是
A.容器①中反应达平衡时用XY3表示的反应速率为v(XY3)=1/30moI.L-l·s-1
B.平衡时,两个容器中XY3的物质的量浓度相等
C.容器②中反应达到平衡时吸收的热量为Q
D.若容器①体积为0.3L,则达平衡时放出的热量大于46.3kJ
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省宜宾市高三第二次诊断测试化学试卷(解析版) 题型:实验题
(16分)黄铁矿是工业上制取硫酸的主要原料,其主要成分为FeS2,含少量杂质(杂质不含S元素,且高温下不反应)。某化学兴趣小组用下列装置测定黄铁矿中硫元素的质量分数。

称取2.0g研细的黄铁矿样品,将样品放入石英管中,缓慢鼓入空气,再加热石英管至800~850℃;锥形瓶中盛装100 mL 0.2mol/L酸性KMnO4溶液用于吸收SO2(忽略SO2、H2SO3与氧气反应);反应结束后,每次从锥形瓶中取出25.00 mL溶液,用0.23mol/L标准H2C2O4溶液滴定,重复三次。
已知:4FeS2+11O2 2Fe2O3+8SO2;2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4
2Fe2O3+8SO2;2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4
请回答下列问题:
(1)连接好装置,检查装置气密性的操作是 。
(2)通入空气的作用是 。
(3)若实验过程中鼓入空气的速率过快,则测得的硫元素的质量分数 。(填“偏高”、“偏低”或“不变”)
(4)滴定时,应选择下图中的 (填字母序号)盛装标准H2C2O4溶液,根据 现象来判断滴定已经达到终点。

(5)滴定过程中发生反应的离子方程式是 。
(6)如果黄铁矿中的硫全部转化为SO2,且被酸性KMnO4溶液完全吸收,滴定操作中,平均耗用0.23mol/L标准H2C2O4溶液21.73mL,则黄铁矿样品中硫元素的质量分数是 。(保留到小数点后1位)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省广安市高三二诊理综化学试卷(解析版) 题型:选择题
能正确表示下列反应离子方程式的是
A.向NaAlO2溶液中通入过量CO2制Al(OH)3:2AlO2-+CO2+3H2O= 2Al(OH)3↓+ CO32-
B.双氧水中加入稀硫酸和KI溶液:2I﹣+H2O2+2H+=I2+O2↑+2H2O
C.Fe2(SO4)3和Ba(OH)2溶液混合:Fe3++SO42-+Ba2++3OH-=Fe(OH)3↓+ BaSO4↓
D.草酸使酸性KMnO4溶液褪色,其离子方程式为:5H2C2O4 + 2MnO4-+ 6H+ = 2Mn2+ + 10CO2↑ + 8H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三“二诊”考试化学试卷(解析版) 题型:选择题
向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水).以下推断正确的是


A.据图计算原溶液中c(Cl一)=c(SO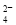 )
)
C.OA段产生的沉淀为BaSO4和Fe(OH)3
B.AB段可能发生的反应是:2SO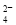 +2Ba2++ Al3+ +3OH-= 2BaSO4+Al(OH)3↓
+2Ba2++ Al3+ +3OH-= 2BaSO4+Al(OH)3↓
D.C点溶液呈碱性的原因是AlO 水解,其离子方程式为:AlO
水解,其离子方程式为:AlO +2H2O=Al(OH)3 +OH一
+2H2O=Al(OH)3 +OH一
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济宁市高三第一次模拟考试理综化学试卷(解析版) 题型:实验题
(19分)某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究。
查阅资料:Cu2O在酸性溶液中会发生反应:
探究一:用下图所示装置进行实验,回答下列问题:

(1)仪器组装完成后,夹好止水夹,__________.则说明装置A的气密性良好。
(2)装置A是氢气的发生装置,可以选用的药品是_________(填选项)
A.稀硫酸和锌片 B.稀硝酸和铁片
C.氢氧化钠溶液和铝片 D.浓硫酸和镁片
(3)从下列实验步骤中,选择正确的操作顺序:①________③(填序号)
①打开止水夹
②熄灭C处的酒精喷灯
③C处冷却至室温后,关闭止水夹
④点燃C处的酒精喷灯
⑤收集氢气并验纯
⑥通入气体一段时间,排尽装置内的空气
(4)收集氢气验纯时,最好采用___________方法收集氢气。
探究二:
(5)取少量样品于试管中,加入适量的稀硫酸,若无红色物质生成,则说明样品中不含Cu2O;此观点是否正确_________。(填“是”或“否”)若填“否”,则原因是_________(用离子方程式说明);另取少量样品于试管中,加入适量的浓硝酸,产生红棕色的气体。
证明样品中一定含有__________,取少量反应后的溶液,加适量蒸馏水稀释后,滴加_________(填试剂和实验现象),则可证明另一成分存在,反之,说明样品中不含该成分。
探究三:
(6)取一定量样品于烧杯中,加入足量的稀硫酸,若反应后经过滤得到固体3.2g,滤液中 有1.0mol,则样品中
有1.0mol,则样品中 ___________mol。
___________mol。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济宁市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
下列实验装置或操作正确的是

A.图l烧杯中通入过量的CO2出现白色沉淀,则溶液中一定含有A1O2-
B.图2装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、氧化性
C.图3装置可以除去乙醇中的乙酸
D.图4装置可以比较碳酸钠、碳酸氢钠的热稳定性
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省德州市高三下学期3月一模化学试卷(解析版) 题型:填空题
选做(12分)【化学——物质结构与性质】
氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①在基态Ti2+中,电子占据的最高能层符号为________,该能层具有的原子轨道数为______。
②BH4-的空间构型是________(用文字描述)。
(2)液氨是富氢物质,是氢能的理想载体,利用 ,实现储氢和输氢。下列说法正确的是________。
,实现储氢和输氢。下列说法正确的是________。
a.[Cu(NH3)4]2+中,N原子是配位原子
b.NH3分子中氮原子的轨道杂化方式为sp2杂化
c.键角NH4+ <NH3
d.相同压强时,NH3的沸点比PH3的沸点高
(3)富氢材料NH3和F2在Cu催化剂存在下反应直接得到NF3

上述化学方程式中的5种物质所属的晶体类型有________(填序号)
a.离子晶体 b.分子晶体
c.原子晶体 d.金属晶体
(4)某种合金材料有较大的储氢容量,其晶体结构的最小单元如图所示。则这种合金的化学式为________________。

查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省湖州市高三上学期期末考试化学试卷(解析版) 题型:填空题
(5分)五种短周期元素A、B、C、D、E,A原子的最外层电子数是次外层的3倍;B是第三周期中除稀有气体外原子半径最大的元素;B和D能形成BD型离子化合物,且B、D的原子核外电子层数相同;C和D能形成CD3的化合物;C原子比E原子多1个电子;1.8 g C与足量的稀H2SO4反应,所产生的氢气在标准状况下的体积为2.24 L;C原子中质子数比中子数少1。则:
(1)元素A在周期表中的位置 。
(2)D与E形成的化合物的电子式 。
(3)A、B、D简单离子的半径大小关系 。(用离子符号表示)
(4)C单质溶于B的最高价氧化物的水化物的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com