
| 压强 A转化率 温度 | P1(MPa) | P2(MPa) |
| 400℃ | 96 | 99 |
| 500℃ | 96 | 97 |
| A. | 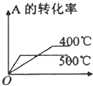 | B. | 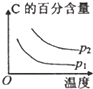 | C. | 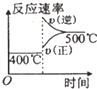 | D. | 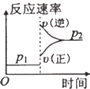 |
分析 由表中数据可知,在相同压强下,升高温度,A的转化率降低,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,在相同温度下,增大压强,A的转化率增大,说明平衡向正反应方向移动,对比图象可解答该题.
解答 解:由表中数据可知,在相同压强下,升高温度,A的转化率降低,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,在相同温度下,增大压强,A的转化率增大,说明平衡向正反应方向移动,则
A.升高温度,A的转化率降低,与表中数据吻合,故A正确;
B.升高温度,平衡向逆反应方向移动,C的百分含量降低,增大压强,平衡向正反应方向移动,C的百分含量增大,与表中数据吻合,故B正确;
C.升高,反应速率增大,平衡向逆反应方向移动,逆反应速率大于正反应速率,与表中数据吻合,故C正确;
D.增大压强,反应速率增大,正反应速率大于逆反应速率平衡向正反应方向移动,图象与表中数据不吻合,故D错误.
故选D.
点评 本题考查温度温度、压强对平衡移动的影响,题目难度中等,注意分析表中数据以及图象的曲线的变化,学习中注意加强该方面能力的培养.


 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④⑤ | B. | 只有⑤⑦ | C. | 只有①③⑦ | D. | 只有①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
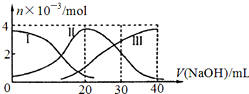
| A. | H2 A在水中的电离方程式是:H2A=H ++HA -;HA -═H++A2- | |
| B. | 当V(NaOH)=20mL时,则有:c(Na + )>c(HA- )>c(H + )>c(A 2- )>c(OH- ) | |
| C. | 当V(NaOH)=30mL时,则有:2c(H + )+c(HA- )+2c(H2A)=c(A 2- )+2 c(OH- ) | |
| D. | 当V(NaOH)=40mL时,其溶液中水的电离受到抑制 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com