
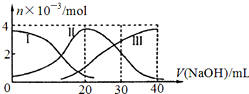
| A. | H2 A在水中的电离方程式是:H2A=H ++HA -;HA -═H++A2- | |
| B. | 当V(NaOH)=20mL时,则有:c(Na + )>c(HA- )>c(H + )>c(A 2- )>c(OH- ) | |
| C. | 当V(NaOH)=30mL时,则有:2c(H + )+c(HA- )+2c(H2A)=c(A 2- )+2 c(OH- ) | |
| D. | 当V(NaOH)=40mL时,其溶液中水的电离受到抑制 |
分析 A.根据图知,溶液中存在HA-、H2A、A2-,说明该酸是二元弱酸,在水溶液中部分电离;
B.当V(NaOH)=20mL时,二者恰好完全反应生成NaHA,溶液中存在HA-、H2A、A2-,说明HA- 能电离和水解,且c(H2A)<c(A 2- ),说明其电离程度大于水解程度,导致溶液呈酸性,其电离和水解程度都较小;
C.当V(NaOH)=30mL时,3n(H2A)=2n(NaOH),发生反应为NaOH+H2A=NaHA+H2O,NaHA+NaOH=Na2A+H2O,溶液主要为等物质量的NaHA,Na2A的混合溶液,根据电荷守恒和物料守恒;
D.当V(NaOH)=40mL时,二者恰好完全反应生成强碱弱酸盐Na2A,含有弱离子的盐促进水电离.
解答 解:A.根据图知,溶液中存在HA-、H2A、A2-,说明该酸是二元弱酸,在水溶液中部分电离,所以其二元酸的电离方程式为H2A?H ++HA -;HA-?H++A2-,故A错误;
B.当V(NaOH)=20mL时,二者恰好完全反应生成NaHA,溶液中存在HA-、H2A、A2-,说明HA- 能电离和水解,且c(H2A)<c(A 2- ),说明其电离程度大于水解程度,导致溶液呈酸性,其电离和水解程度都较小,则溶液中离子浓度大小顺序是:c(Na + )>c(HA- )>c(H + )>c(A 2- )>c(OH- ),故B正确;
C.当V(NaOH)=30mL时,发生反应为NaOH+H2A=NaHA+H2O,NaHA+NaOH=Na2A+H2O,溶液主要为等物质量的NaHA,Na2A的混合溶液,根据电荷守恒得:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-)①,物料守恒可知:3c(HA-)+3c(A2-)+3c(H2A)=2c(Na+)②,①×2+②得:2c(H+)+c(HA-)+3c(H2A)═c(A2-)+2c(OH-),故C错误;
D.当V(NaOH)=40mL时,二者恰好完全反应生成强碱弱酸盐Na2A,含有弱离子的盐促进水电离,所以Na2A促进水电离,故D错误;
故选B.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生分析判断及图象分析能力,明确曲线变化趋势及其原理、溶液中溶质成分及其性质是解本题关键,正确运用溶液中存在的守恒,题目难度不大.


 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:解答题
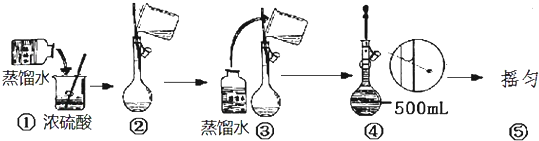

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 压强 A转化率 温度 | P1(MPa) | P2(MPa) |
| 400℃ | 96 | 99 |
| 500℃ | 96 | 97 |
| A. | 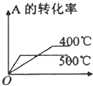 | B. | 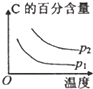 | C. | 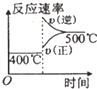 | D. | 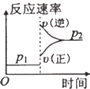 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2OH+CuO $\stackrel{△}{→}$ CH3CH2CHO+H2O+Cu | |
| B. | CH3-C≡CH+HCl $\stackrel{催化剂}{→}$ CH3CCl=CH2 | |
| C. | CH3CH2CH2Cl+NaOH $→_{△}^{醇}$ CH3CH=CH2+NaCl+H2O | |
| D. | CH3CH2CH2Cl+NaOH$\stackrel{△}{→}$ CH3CH2CH2OH+NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.80 mol | B. | 0.72 mol | C. | 0.45 mol | D. | 0.40 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是非极性分子 | B. | 中心原子都采取sp杂化 | ||
| C. | S原子和C原子都没有孤对电子 | D. | SO2为V形结构,CO2为直线形结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com