
 一定温度下在体积为5L的密闭容器中发生可逆反应.
一定温度下在体积为5L的密闭容器中发生可逆反应.分析 (I)根据平衡常数的定义,生成物浓度的幂之积与反应物浓度的幂之积之比为平衡常数;
(Ⅱ)(1)根据反应速率的计算公式,求v(H2)即可;
(2)加入Fe后,Fe是固体,平衡不移动;
(3)如右图t3时刻,反应速率突然增大,可能是温度或者浓度的变化.
解答 解:(Ⅰ)根据平衡常数的定义,生成物浓度的幂之积与反应物浓度的幂之积之比为平衡常数,所以方程式为:C(s)+H2O(g)?CO(g)+H2 (g),
故答案为:C(s)+H2O(g)?CO(g)+H2 (g);
(Ⅱ)(1)根据反应速率的计算公式,v(H2)=$\frac{0.03}{({t}_{2}-{t}_{1})}$ mol•L-1•s-1.故答案为:$\frac{0.03}{({t}_{2}-{t}_{1})}$ mol•L-1•s-1
(2)加入Fe后,Fe是固体,平衡不移动;故答案为:不;
(3)如右图t3时刻,逆反应反应速率突然增大,而后逆反应速率减小,反应向逆反应方向进行,可能是增大氢气浓度,正反应为放热反应,也可能是升高温度,
故答案为:升高了温度或增大了H2的浓度.
点评 本题是一道化学反应速率与平衡的综合题,考查了平衡常数的含义和化学反应速率的计算,综合性强,难度较大.


科目:高中化学 来源: 题型:选择题
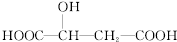 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 1mol苹果酸可与3 mol NaOH发生中和反应 | |
| B. | 1mol苹果酸与足量金属Na反应生成1mol H2 | |
| C. | 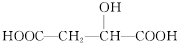 与苹果酸互为同分异构体 与苹果酸互为同分异构体 | |
| D. | 苹果酸中能发生酯化反应的官能团有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②⑤⑥⑦ | C. | ①③④⑤⑥ | D. | 除①②外 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有放热反应均是自发反应,也是熵增大的反应 | |
| B. | 向AgCl固液混合物中滴入KI饱和溶液,有AgI沉淀生成,说明AgCl的溶解度小于有AgI的溶解度 | |
| C. | 锌与稀硫酸反应制取氢气,加入少量的硫酸铜粉末会使产生氢气的速度减慢 | |
| D. | 用电解法精炼粗铜时,粗铜板作阳极,纯铜板作阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验步骤 | 实验现象 |
| ①取少量该溶液,加几滴石蕊溶液 | 溶液变红色 |
| ②取少量该溶液,加入铜片和浓硫酸,加热 | 有无色气体产生,遇空气可以变成红棕色 |
| ③取少量该溶液,加入BaCl2溶液 | 有白色沉淀生成 |
| ④取③中的上层清液,加入AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于稀硝酸 |
| ⑤取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
| A. | 溶液中一定存在的离子是SO42-、Mg2+、Al3+、Cl- | |
| B. | 溶液中一定存在的离子是NO3-、SO42-、Mg2+、Al3+ | |
| C. | 溶液中肯定不存在的离子是Fe2+、HCO3-、I-、SO42- | |
| D. | 溶液中肯定不存在的离子是Fe2+、HCO3-、Mg2+、I-、Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验事实 | 解释或结论 |
| A | 2N2O5(g)?4NO2(g)+O2(g)△H>0 在室温下能自发进行 | 这是一个熵增的反应 |
| B | 向0.1mol•L-1的氨水中通入少量氨气,溶液的pH减小 | 电离平衡向逆方向移动,溶液中的c(OH-) 减小 |
| C | 锌与稀硫酸反应过程中,开始反应后速率逐渐增大 | 该反应是放热反应 |
| D | 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 | 反应物的浓度一定降低 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
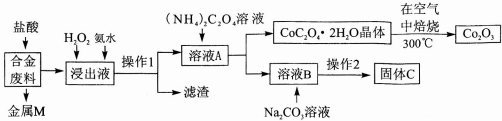
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol•L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com