
【题目】A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素,F还是前四周期中电负性最小的元素。已知:A原子的核外电子数与电子层数相等;B元素原子的核外p电子数比s电子数少1个;C原子的第一至第四电离能为I1=738 kJ·mol-1,I2=1 451 kJ·mol-1,I3=7 733 kJ·mol-1,I4=10 540 kJ·mol-1;D原子核外所有p轨道为全充满或半充满;E元素的族序数与周期序数的差为4。
(1)写出E元素在周期表中位置:________;D元素的原子的核外电子排布式:__________________。
(2)某同学根据题目信息和掌握的知识分析C的核外电子排布为![]() 该同学所画的轨道式违背了________。
该同学所画的轨道式违背了________。
(3)已知BA5为离子化合物,写出其电子式:________。
(4)DE3中心原子杂化方式为________,其空间构型为_________________。
【答案】(1)第三周期第ⅦA族 1s22s22p63s23p3(2)能量最低原理(3)(4)sp3三角锥形
【解析】
A、B、C、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素,F还是前四周期中电负性最小的元素,则F为K元素;A原子的核外电子数与电子层数相等,则A为H元素;B元素原子的核外p电子数比s电子数少1个,核外电子排布式为1s22s22p3,则B为N元素;C原子第三电离能剧增,原子最外层有2个电子,原子序数大于N元素,故C为Mg;D原子核外所有p轨道为全充满或半充满,处于VA族,原子序数大于Mg,故D为P元素;E元素的族序数与周期序数的差为4,E处于第三周期,E处于第ⅦA族,故E为Cl元素。
(1)E为Cl元素,在周期表位置:第三周期第ⅦA族;D为P元素,原子的核外电子排布式:1s22s22p63s23p3;(2)某同学根据上述信息,推断C基态原子的核外电子排布为![]() ,该同学所画的电子排布图中3s能级未填充满,就填充能量更高的3p能级,违背了能量最低原理;(3)NH5为离子化合物,是由NH4+与H-两种粒构成,电子式为
,该同学所画的电子排布图中3s能级未填充满,就填充能量更高的3p能级,违背了能量最低原理;(3)NH5为离子化合物,是由NH4+与H-两种粒构成,电子式为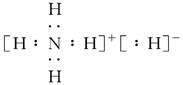 ;(4)PCl3中心原子P原子成3个σ键,P原子价层电子对是为3+(51×3)/2=4,含有1对孤对电子对,杂化轨道数为4,杂化方式为sp3,其空间构型为三角锥形。
;(4)PCl3中心原子P原子成3个σ键,P原子价层电子对是为3+(51×3)/2=4,含有1对孤对电子对,杂化轨道数为4,杂化方式为sp3,其空间构型为三角锥形。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案科目:高中化学 来源: 题型:
【题目】相对分子质量约为4000的聚乙二醇具有良好的水溶性,是一种缓泻剂。聚乙二醇可由环氧乙烷在酸性条件下聚合而成(![]() )。下列说法正确的是
)。下列说法正确的是
A.环氧乙烷在酸性条件下发生加聚反应制得聚乙二醇
B.聚乙二醇的结构简式为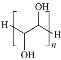
C.相对分子质量约为4000的聚乙二醇的聚合度n≈67
D.聚乙二醇能保持肠道水分的原因是其可和H2O分子间形成氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知苯与一卤代烷在催化剂作用下可生成苯的同系物:![]() +CH3X→
+CH3X→![]() +HX,在催化剂存在下,由苯和下列各组物质合成乙苯最好应选用的是
+HX,在催化剂存在下,由苯和下列各组物质合成乙苯最好应选用的是
A.CH2=CH2和HClB.CH3CH3和I2
C.CH2=CH2和Cl2D.CH3CH3和HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均是短周期元素,其原子序数依次增大,A和B同周期,A和D同主族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C的阳离子电子层结构相同,C的单质与B的单质在不同条件下反应,可生成C2B或C2B2,E是所在周期中原子半径最小的元素。请回答:
(1)D在元素周期表中的位置是 。
(2)C2B的电子式是 ;AB2的结构式是 。
(3)B、C、E的离子半径由大到小的顺序为 (用化学式回答,下同);A、D、E元素最高价氧化物对应水化物的酸性由强到弱为 。
(4)B的气态氢化物与H2S相比沸点高的是 (用化学式回答);原因是 。
(5)水中锰含量超标,容易使洁具和衣物染色,使水产生异味,EB2可以用来除去水中超标的Mn2+,生成黑色沉淀MnO2,当消耗13.50gEB2时,共转移了1mol电子,则反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是

A. 用装置甲制取一氯甲烷
B. 用装置乙在实验室制取氨气
C. 用装置丙萃取溴水中的溴
D. 用装置丁在实验室制蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂一铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O==2Cu+2Li++2OH-,下列说法不正确的是

A. 放电时,正极的电极反应式为Cu2O+H2O+2e-=2OH-+2Cu
B. 放电时,电子透过固体电解质向Li极移动
C. 通空气时,铜电极被腐蚀,表面产生Cu2O
D. 整个反应过程中,氧化剂为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用下图装置进行实验,K接N,试回答:
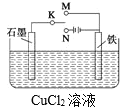
(1)石墨极为______极(填“正”、“负”、“阳” 或“阴”),铁极上的电极反应为:_______。电池总反应为:________。Cu2+向____(填“石墨”或“铁”)电极移动。
(2)若反应过程中有0.1mol的电子发生转移,则铁电极上产生物质的质量为____g,石墨极上产生的物质的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在新型冠状病毒疫情中常用84消毒液进行消毒,有效成分为NaClO溶液,其主要是基于次氯酸(HClO)的氧化性。氯所在的卤族元素在生产生活中有广泛应用,回答以下问题:
(1)基态氯原子的核外价电子排布式为__________,HClO分子中中心原子的杂化轨道类型为__________。
(2)生产农药的原料PSCl3中,P、S、Cl的电负性由大到小的顺序为_________。
(3)①与Cl相邻的元案S、F,其化化物SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(a)计算相关键能,则S-F键的键能为__________。
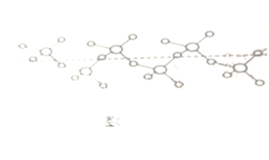
②硫和氧形成的链状化合物结构如图(C),其化学式为__________。
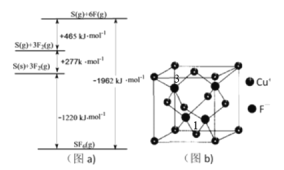
(4)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃。
①CuF的熔点比CuCl的高,原因是_________。
②工业上将CuCl溶入KCN溶液中配制成镀铜液,镀铜液中配合物化学式为__________,写出一种与配体互为等电子体的阳离子的电子式__________。
③CuF晶胞如图(b),晶胞边长为a nm。则Cu+与F-最近的距离为________。用Mg·mol-1表示CuF的摩尔质量,NA表示阿伏加德罗常数的值,则CuF晶体的密度为______g·cm-3。
④以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图(b)中离子1的坐标为(![]() ,
,![]() ,0),则离子3的坐标为__________。
,0),则离子3的坐标为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室需要0.5mol·L-1硫酸溶液450mL。根据溶液的配制情况回答下列问题:
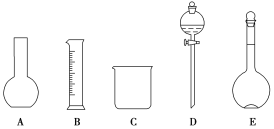
(1)如图所示的仪器中配制溶液肯定不需要的是__(填序号),配制上述溶液还需用到的玻璃仪器是___(填仪器名称)。
(2)现用质量分数为98%、密度为1.84g·cm-3的浓硫酸来配制450mL、0.5mol·L-1的稀硫酸。计算所需浓硫酸的体积为__mL(保留1位小数),现有①10mL ②25mL ③50mL ④100mL四种规格的量筒,你选用的量筒是__(填代号)。
(3)配制时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为:②→①→③→⑧→__→__→__→_(填序号)。__
(4)在配制过程中,下列操作中错误的是__(填代号,下同),其他操作都准确,能引起误差偏高的有__。
①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
④定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至刻度线
⑦定容时,俯视刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com