
【题目】氮的重要化合物如氨(NH3)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用。
(1) 利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g) △H1=44.0 kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2=229.3 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-906.5 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H4
则△H4=_______kJ·mol-1。
(2)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
① 写出该反应的离子方程式:________。
② 在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为:________;为抑制肼的分解,可采取的合理措施有________(任写一种)。
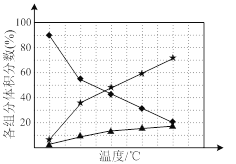
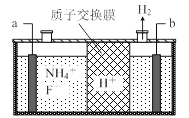
图1 图2
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示。
① 氮化硅的化学式为___________________。
② a电极为电解池的_____________(填“阴”或“阳”)极,写出该电极的电极反应式:________________;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是_______________。
【答案】-2317.0 Co2++N2H4+4OH-=2Co↓+N2↑+4H2O 3N2H4![]() N2+4NH3 降低温度 Si3N4 阳 NH4++3F--6e-=NF3+4H+ F2
N2+4NH3 降低温度 Si3N4 阳 NH4++3F--6e-=NF3+4H+ F2
【解析】
(1)根据盖斯定律分析,反应③-②×5-①×6得热化学方程式为4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H4=-906.5-(229.3×5)-(44×6)= -2317.0kJ/mol。
(2)①根据题意,钴元素的化合价降低,所以氮元素化合价升高,只能为0价,即为氮气,据此分析还有水生成,根据得失电子守恒和原子守恒配平方程式为Co2++N2H4+4OH-=2Co↓+N2↑+4H2O
②使湿润的红色石蕊试纸变蓝的气体为氨气,即肼分解生成氨气,依据元素守恒可知,另外一种产物为氮气,所以方程式为3N2H4![]() N2+4NH3;从图分析,温度越高,肼的体积分数含量越低,所以要抑制肼的分解,应降低温度。
N2+4NH3;从图分析,温度越高,肼的体积分数含量越低,所以要抑制肼的分解,应降低温度。
(3)①氮化硅中氮的非金属性强于硅,硅显+4价,氮显-3价,所以氮化硅的化学式为Si3N4
②由图2可知,氢离子在b极上得到电子生成氢气,所以b为阴极,a为阳极。阳极铵根离子失去电子生成三氟化氮,电极反应为 NH4++3F--6e-=NF3+4H+;依据电解原理可知,氟离子也可能失去电子生成氟单质,所以氧化性较强的单质为氟气。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】乙炔是一种无色无味的气体,微溶于水,易溶于有机溶剂。实验室常用如图所示装置制取乙炔,并验证乙炔的性质。完成实验,观察实验现象,回答下列问题:

(1)写出电石(碳化钙CaC2)与水反应,制取乙炔的化学方程式_________
(2)用饱和食盐水代替蒸馏水的目的是____________
(3)装置A的作用是_________,装置B中的现象是___________
(4)若称取a g CaC2,反应完全后,将生成的乙炔全部通入足量溴的CCl4溶液中溶液增重b g,则CaC2的纯度为____________(用百分数表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,在三个干燥的烧瓶内分别装有纯净的NH3,含一半空气的HCl气体, NO2 和O2的混合气体[V(NO2)∶V(O2) = 4∶1 ],然后分别作喷泉实验,三个烧瓶内所得溶液的物质的量浓度之比为
A. 2∶1∶2 B. 5∶5∶4 C. 1∶1∶1 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,室温下向盛有3.0 mL NO的试管中缓缓通入1.5 mL O2(所有气体体积均在标准状况下测定)。

试回答下列问题:
(1)写出观察到的现象(可不写满,也可补充):
①___________;
②___________;
③___________。
(2)最终试管中剩余的气体是______,体积为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收ZnSO4溶液的有机高聚物做固态电解质,其电池总反应为:
MnO2+![]() Zn +(1+
Zn +(1+![]() )H2O+
)H2O+![]() ZnSO4
ZnSO4![]() MnOOH+
MnOOH+![]() ZnSO4[Zn(OH)2]3·xH2O
ZnSO4[Zn(OH)2]3·xH2O
其电池结构如图1所示,图2是有机高聚物的结构片段。


下列说法中,不正确的是
A. 碳纳米管具有导电性,可用作电极材料
B. 放电时,电池的正极反应为:MnO2+e+H+==MnOOH
C. 充电时,Zn2+移向Zn膜
D. 合成有机高聚物的单体是:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)重整制取H2,具有无毒、无刺激性等优点。回答下列问题:
(1) CH3OCH3和O2发生反应I:CH3OCH3(g)+![]() O2(g)=2CO(g)+3H2(g)△H
O2(g)=2CO(g)+3H2(g)△H
已知:CH3OCH3(g)![]() CO(g)+H2(g)+CH4(g)△H1
CO(g)+H2(g)+CH4(g)△H1
CH4(g)+![]() O2(g)=CO(g)+2H2O (g)△H2
O2(g)=CO(g)+2H2O (g)△H2
H2(g)+![]() O2(g)=H2O (g)△H3
O2(g)=H2O (g)△H3
①则反应I的△H=____________________(用含△H1、△H2、△H3的代数式表示)。
②保持温度和压强不变,分别按不同进料比通入CH3OCH3和O2,发生反应I。测得平衡时H2的体积百分含量与进料气中n(O2)/n(CH3OCH3)的关系如图所示。当![]() >0.6时,H2的体积百分含量快速降低,其主要原因是____(填标号)。
>0.6时,H2的体积百分含量快速降低,其主要原因是____(填标号)。

A.过量的O2起稀释作用
B.过量的O2与H2发生副反应生成H2O
C.![]() >0.6平衡向逆反应方向移动
>0.6平衡向逆反应方向移动
(2)T℃时,在恒容密闭容器中通入CH3OCH3,发生反应II:CH3OCH3(g)![]() CO(g)+H2(g)+CH4(g),测得容器内初始压强为41.6 kPa,反应过程中反应速率v(CH3OCH3)时间t与CH3OCH3分压P(CH3OCH3)的关系如图所示。
CO(g)+H2(g)+CH4(g),测得容器内初始压强为41.6 kPa,反应过程中反应速率v(CH3OCH3)时间t与CH3OCH3分压P(CH3OCH3)的关系如图所示。

①t=400 s时,CH3OCH3的转化率为________(保留2位有效数字);反应速率满足v(CH3OCH3)=kPn(CH3OCH3),k=_________s-1;400 s时v(CH3OCH3)=_________kPas-1。
②达到平衡时,测得体系的总压强P总= 121.6 kPa,则该反应的平衡常数Kp=________________kPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③该温度下,要缩短达到平衡所需的时间,除改进催化剂外,还可采取的措施是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.标准状况下2.24LCO2通入1mol/L100mLNaOH溶液中:CO2+OH-→HCO3-
B.氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+→Fe3++3H2O
C.Na2S水解:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
D.等物质的量的NH4HCO3与NaOH在溶液中反应:NH4++HCO3-+2OH-→CO32-+NH3+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150 mL 4 mol·L-1的稀硝酸恰好使混合物完全溶解,放出2.24 L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
A. 0.21 mol B. 0.25 mol C. 0.3 mol D. 0.35 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol白磷(P4,s)和4mol红磷(P,s)与氧气反应过程中的能量变化如图(E表示能量)。下列说法正确的是( )
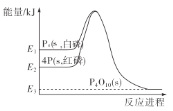
A. P4(s,白磷)=4P(s,红磷) ΔH>0
B. 以上变化中,白磷和红磷所需活化能相等
C. 白磷比红磷稳定
D. 红磷燃烧的热化学方程式是4P(s,红磷)+5O2(g)=P4O10(s) ΔH=-(E2-E3)kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com