
【题目】二甲醚(CH3OCH3)重整制取H2,具有无毒、无刺激性等优点。回答下列问题:
(1) CH3OCH3和O2发生反应I:CH3OCH3(g)+![]() O2(g)=2CO(g)+3H2(g)△H
O2(g)=2CO(g)+3H2(g)△H
已知:CH3OCH3(g)![]() CO(g)+H2(g)+CH4(g)△H1
CO(g)+H2(g)+CH4(g)△H1
CH4(g)+![]() O2(g)=CO(g)+2H2O (g)△H2
O2(g)=CO(g)+2H2O (g)△H2
H2(g)+![]() O2(g)=H2O (g)△H3
O2(g)=H2O (g)△H3
①则反应I的△H=____________________(用含△H1、△H2、△H3的代数式表示)。
②保持温度和压强不变,分别按不同进料比通入CH3OCH3和O2,发生反应I。测得平衡时H2的体积百分含量与进料气中n(O2)/n(CH3OCH3)的关系如图所示。当![]() >0.6时,H2的体积百分含量快速降低,其主要原因是____(填标号)。
>0.6时,H2的体积百分含量快速降低,其主要原因是____(填标号)。

A.过量的O2起稀释作用
B.过量的O2与H2发生副反应生成H2O
C.![]() >0.6平衡向逆反应方向移动
>0.6平衡向逆反应方向移动
(2)T℃时,在恒容密闭容器中通入CH3OCH3,发生反应II:CH3OCH3(g)![]() CO(g)+H2(g)+CH4(g),测得容器内初始压强为41.6 kPa,反应过程中反应速率v(CH3OCH3)时间t与CH3OCH3分压P(CH3OCH3)的关系如图所示。
CO(g)+H2(g)+CH4(g),测得容器内初始压强为41.6 kPa,反应过程中反应速率v(CH3OCH3)时间t与CH3OCH3分压P(CH3OCH3)的关系如图所示。

①t=400 s时,CH3OCH3的转化率为________(保留2位有效数字);反应速率满足v(CH3OCH3)=kPn(CH3OCH3),k=_________s-1;400 s时v(CH3OCH3)=_________kPas-1。
②达到平衡时,测得体系的总压强P总= 121.6 kPa,则该反应的平衡常数Kp=________________kPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③该温度下,要缩短达到平衡所需的时间,除改进催化剂外,还可采取的措施是________。
【答案】△H1+△H2-2△H3 B 16% 4.4×10-4 1.54×10-2kPa/s 4×104 增大反应物的压强或浓度
【解析】
(1) ①已知:i.CH3OCH3(g)![]() CO(g)+H2(g)+CH4(g)△H1
CO(g)+H2(g)+CH4(g)△H1
ii.CH4(g)+![]() O2(g)=CO(g)+2H2O (g)△H2
O2(g)=CO(g)+2H2O (g)△H2
iiiH2(g)+![]() O2(g)=H2O (g)△H3
O2(g)=H2O (g)△H3
根据盖斯定律i+ii-iii×2得:CH3OCH3(g)+![]() O2(g)=2CO(g)+3H2(g)△H=△H1+△H2-2△H3;
O2(g)=2CO(g)+3H2(g)△H=△H1+△H2-2△H3;
②过量的O2与H2发生副反应生成H2O,从而使H2的体积百分含量快速降低,A、C选项不能使H2的体积百分含量快速降低,故选B;
(2)①t=400 s时,CH3OCH3分压P(CH3OCH3)=35.0kPa,测得容器内初始压强为41.6 kPa,根据等温等容条件下,压强之比等于物质的量之比,可知转化率=![]() ×100%=16%;
×100%=16%;
由图象可知,当P(CH3OCH3)=10.0kPa时,v(CH3OCH3)=4.4×10-3kPa·s-1,根据v(CH3OCH3)=kPn(CH3OCH3),化学方程式中CH3OCH3的系数为1,所以n=1,解得k=4.4×10-4s-1;
由图象可知,400 s时P(CH3OCH3)=35.0kPa,则v(CH3OCH3)= 4.4×10-4s-1×35kPa=1.54×10-2kPa/s;
②达到平衡时,测得体系的总压强P总=121.6 kPa,设起始通入的CH3OCH3物质的量为41.6mol,反应消耗甲醚物质的量为x,列三段式有:
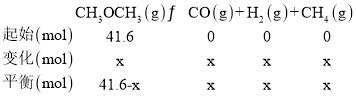
根据气体的压强之比等于气体物质的量之比有(41.6+2x):41.6=121.6:41.6,解得x=40mol,则平衡时CH3OCH3(g)、CO(g)、H2(g)、CH4(g)的物质的量分别为1.6mol、40mol、40mol、40mol,则平衡时CH3OCH3(g)、CO(g)、H2(g)、CH4(g)的分压为1.6kPa、40kPa、40 kPa、40 kPa,则该反应的平衡常数Kp=![]() ==4
==4![]() 104kPa2;
104kPa2;
③该温度下,要缩短达到平衡所需的时间,除改进催化剂外,还可以增大反应物的压强或增大反应物的浓度使反应速率加快。


科目:高中化学 来源: 题型:
【题目】今有如下3个热化学方程式:H2(g)+![]() O2(g)= H2O(g) △H=a kJ/mol,H2(g)+
O2(g)= H2O(g) △H=a kJ/mol,H2(g)+ ![]() O2(g)= H2O(l) △H=b kJ/mol,2H2(g) +
O2(g)= H2O(l) △H=b kJ/mol,2H2(g) + ![]() O2(g)= 2H2O(l) △H=c kJ/mol,关于它们的下列表述正确的是:
O2(g)= 2H2O(l) △H=c kJ/mol,关于它们的下列表述正确的是:
A.它们都是吸热反应B.a、b、c均为正值C.a=bD.c=2b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯MnCO3在电子工业中有重要的应用,工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如图所示:

已知:还原焙烧主反应为2MnO2+C![]() 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:

根据要求回答下列问题:
(1)在实验室进行步骤A,混合物应放在__________中加热。
(2)步骤E中调节pH的范围为____________,其目的是______________________________。
(3)步骤G,温度控制在35℃以下的原因是____________________________________,若Mn2+恰好沉淀完全(当离子浓度≦10-5mol/L认为该离子沉淀完全)时测得溶液中![]() 的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=____________。
的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=____________。
(4)步骤D中氧化剂与还原剂的物质的量之比为__________;步骤C中的滤渣为__________。
(5)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否干净的方法是_____________________。
(6)现用滴定法测定产品中锰元素的含量。实验步骤:称取3.300 g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnCO3完全转化为[Mn(PO4)2]3-(其中![]() 完全转化为
完全转化为![]() );加入稍过量的硫酸铵,发生反应NO2-+
);加入稍过量的硫酸铵,发生反应NO2-+![]() =N2↑+2H2O以除去
=N2↑+2H2O以除去![]() ;加入稀硫酸酸化,再加入60.00 mL 0.500 mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2
;加入稀硫酸酸化,再加入60.00 mL 0.500 mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2![]() ;用5.00 mL 0.500 mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
;用5.00 mL 0.500 mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为_____________________________________。
②试样中锰元素的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2(g) ![]() N2O4(g) ΔH<0)
N2O4(g) ΔH<0)
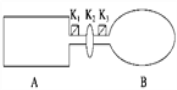
(1)一段时间后,反应达到平衡,此时A、B中生成N2O4的速率是vA______vB(填“>”、“<”或“=”);若打开活塞K2,气球B将______(填“变大”、“变小”或“不变”).
(2)关闭活塞K2,若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将________(填“增大”、“减小”或“不变”);若分别通入等量的氖气,则达到平衡时,A中NO2的转化率将________,B中NO2的转化率将______(填“变大”、“变小”或“不变”).
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,______中的颜色较深.
(4)若在容器A中充入4.6 g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的重要化合物如氨(NH3)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用。
(1) 利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g) △H1=44.0 kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2=229.3 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-906.5 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H4
则△H4=_______kJ·mol-1。
(2)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
① 写出该反应的离子方程式:________。
② 在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为:________;为抑制肼的分解,可采取的合理措施有________(任写一种)。
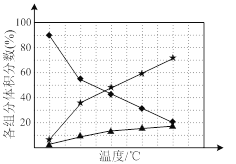
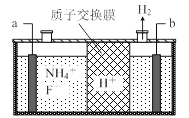
图1 图2
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示。
① 氮化硅的化学式为___________________。
② a电极为电解池的_____________(填“阴”或“阳”)极,写出该电极的电极反应式:________________;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用14.2 g无水硫酸钠配制成500 mL溶液,其物质的量浓度为___ mol·L-1。
(2)若从中取出50 mL,其物质的量浓度为___ mol·L-1;溶质的质量为___ g。
(3)若将这50 mL溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为___ mol·L-1,SO42-的物质的量浓度为___ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,pH=2的两种一元酸x和y,体积均为100mL,稀释过程中pH与溶液体积的关系如图所示。分别滴加NaOH溶液至滴定终点,消耗NaOH溶液的体积为Vx、Vy,则

A.x为弱酸,Vx<VyB.x为强酸,Vx>Vy
C.y为弱酸,Vx<VyD.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
制备K2FeO4(夹持装置略)
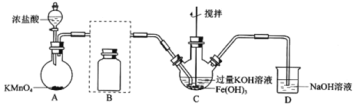
(1)A为氯气发生装置,A中反应离子方程式是:___。
(2)将除杂装置B补充完整并标明所用试剂。___。
(3)C中得到紫色固体和溶液。C中Cl2发生的反应有:3Cl2+2Fe(OH)3+10KOH→2K2FeO4+6KCl+8H2O,另外还有:___。
(4)已知Cl2与KOH在较高温度下反应生成KClO3。为了保证生产KClO,在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是:___、__。
探究K2FeO4的性质
(5)高铁酸钾常用于工业废水与城市生活污水的处理,可用作高效水处理剂,表现在水中与污染物作用的过程中,经过一系列反应,由六价降至三价后,能对水产生净化作用的原因是(结合离子方程式回答):____。
(6)取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2,为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案I | 取少量a,滴加KSCN溶液至过量,溶液呈红色 |
方案II | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生 |
i.由方案I中溶液变红可知a中含有__离子,但该离子的产生不能判断一定K2FeO4将Cl-氧化,还可能由___产生(用离子方程式表示)。
ii.方案II可证明K2FeO4氧化了Cl-。
(7)用KOH溶液洗涤的目的是___。
(8)根据K2FeO4的制备实验得出:氧化性Cl2__FeO42-(填“>”或“<”),而方案II实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是___。
(9)资料表明,酸性溶液中的氧化性FeO42->MnO42-,验证实验如下:
将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性FeO42->MnO42-,若能,请说明理由;若不能,进一步设计实验方案,理由或方案:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)若将饱和FeCl3溶液分别滴入下列物质中,能形成胶体的是________(填字母)。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)现有甲、乙、丙三名同学进行Fe(OH)3胶体的制备:
①甲同学的操作:取一小烧杯,加入25 mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。请评价该操作是否正确______。
②乙直接加热饱和FeCl3溶液,请评价是否正确______。
③丙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟,请评价是否正确________。
(3)写出制备Fe(OH)3胶体的化学方程式: ____________________。证明有Fe(OH)3胶体生成的实验操作是_____________________。该操作利用胶体的性质是________。
(4)Fe(OH)3胶体稳定存在的主要原因是____________________(填字母,下同)。
A.胶体粒子直径小于1nm B.胶体粒子带正电荷
C.胶体粒子作布朗运动 D.胶体粒子能透过滤纸
(5)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是________。
A.Fe(OH)3胶体粒子的直径在1~100 nm之间
B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一的分散系
D.Fe(OH)3胶体的分散质能透过滤纸
(6)若取少量制得的胶体加入试管中,加入硫酸铵溶液,现象是_____________,这种现象称为胶体的________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com