
【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
制备K2FeO4(夹持装置略)
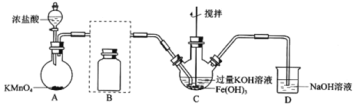
(1)A为氯气发生装置,A中反应离子方程式是:___。
(2)将除杂装置B补充完整并标明所用试剂。___。
(3)C中得到紫色固体和溶液。C中Cl2发生的反应有:3Cl2+2Fe(OH)3+10KOH→2K2FeO4+6KCl+8H2O,另外还有:___。
(4)已知Cl2与KOH在较高温度下反应生成KClO3。为了保证生产KClO,在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是:___、__。
探究K2FeO4的性质
(5)高铁酸钾常用于工业废水与城市生活污水的处理,可用作高效水处理剂,表现在水中与污染物作用的过程中,经过一系列反应,由六价降至三价后,能对水产生净化作用的原因是(结合离子方程式回答):____。
(6)取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2,为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案I | 取少量a,滴加KSCN溶液至过量,溶液呈红色 |
方案II | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生 |
i.由方案I中溶液变红可知a中含有__离子,但该离子的产生不能判断一定K2FeO4将Cl-氧化,还可能由___产生(用离子方程式表示)。
ii.方案II可证明K2FeO4氧化了Cl-。
(7)用KOH溶液洗涤的目的是___。
(8)根据K2FeO4的制备实验得出:氧化性Cl2__FeO42-(填“>”或“<”),而方案II实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是___。
(9)资料表明,酸性溶液中的氧化性FeO42->MnO42-,验证实验如下:
将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性FeO42->MnO42-,若能,请说明理由;若不能,进一步设计实验方案,理由或方案:__。
【答案】2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O  3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O 将装置C中的三颈烧瓶放在冰水浴 在通入氯气的过程中不断搅拌 4FeO42-+10H2O=4Fe(OH)3+3O2↑+8OH-,生成的Fe(OH)3具有净水作用 Fe3+ 4FeO42-+20H+=4Fe3++3O2↑+10H2O 使K2FeO4稳定溶出,并把K2FeO4表面吸附的ClO-除尽,防止ClO-与Cl-在酸性条件下反应产生Cl2,避免ClO-干扰实验 > 溶液酸碱性不同 能说明,理由:FeO42-在过量酸的作用下完全转化为Fe3+和O2,溶液浅紫色一定是MnO42-的颜色;不能说明,方案:向紫色溶液b中滴加过量稀硫酸,观察溶液紫色快速褪去还是显浅紫色。
3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O 将装置C中的三颈烧瓶放在冰水浴 在通入氯气的过程中不断搅拌 4FeO42-+10H2O=4Fe(OH)3+3O2↑+8OH-,生成的Fe(OH)3具有净水作用 Fe3+ 4FeO42-+20H+=4Fe3++3O2↑+10H2O 使K2FeO4稳定溶出,并把K2FeO4表面吸附的ClO-除尽,防止ClO-与Cl-在酸性条件下反应产生Cl2,避免ClO-干扰实验 > 溶液酸碱性不同 能说明,理由:FeO42-在过量酸的作用下完全转化为Fe3+和O2,溶液浅紫色一定是MnO42-的颜色;不能说明,方案:向紫色溶液b中滴加过量稀硫酸,观察溶液紫色快速褪去还是显浅紫色。
【解析】
(1)高锰酸钾溶液与浓盐酸加热反应生成氯化钾、氯化锰、氯气和水,据此写出离子方程式;
(2)浓盐酸具有挥发性,因此产生的氯气中含有少量的氯化氢和水蒸气,因此为了不影响后续实验,除杂装置B中加入饱和食盐水,据此进行分析;
(3)由于KOH过量, Cl2与KOH也能发生反应;
(4)控制反应在0℃~5℃进行,采用的方法能够达到降温的目的即可;
(5)根据信息可知,碱性环境下,FeO42-发生氧化还原反应,产生Fe(OH)3胶体,具有较强的吸附作用,能够净水;
(6)i.Fe3+与KSCN溶液相遇,溶液呈红色;K2FeO4在酸性溶液中快速产生O2,自身会转化为Fe3+,据此写出离子方程式;
(7)K2FeO4晶体在碱性条件下较稳定,使用KOH溶液溶出可以使K2FeO4稳定析出,同时K2FeO4固体表面可能吸附ClO-,ClO-在酸性条件下可与Cl-反应生成Cl2,从而干扰实验;
(8)K2FeO4的制备实验中,Fe(OH)3在碱性条件下被Cl2氧化为FeO42-,Cl2为氧化剂,FeO42-为氧化产物,氧化剂的氧化性强于氧化产物的氧化性,则Cl2的氧化性强于FeO42-;而方案Ⅱ中,FeO42-在酸性条件下氧化Cl-生成Cl2,FeO42-为氧化剂,Cl2为氧化产物,则FeO42-的氧化性强于Cl2;据此进行分析;
(9)FeO42-在过量酸的作用下完全转化为Fe3+和O2,Mn2+被氧化为MnO42-,溶液浅紫色,故能说明氧化性FeO42->MnO42-。
(1)高锰酸钾溶液与浓盐酸混合,反应生成氯化钾、氯化锰、氯气和水,A中反应离子方程式是:2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O;
故答案是:2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O;
(2)浓盐酸具有挥发性,因此产生的氯气中含有少量的氯化氢,为了不影响后续实验,除杂装置B中加入饱和食盐水,用以除去氯化氢,B中导管应为“长进短出”,如图所示: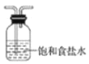 ;
;
故答案是: ;
;
(3)由于KOH过量,Cl2与KOH反应生成氯化钾和次氯酸钾,离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
故答案是:Cl2+2OH-=Cl-+ClO-+H2O;
(4)若要控制反应在0℃~5℃进行,实验时将装置C中的三颈烧瓶放在冰水浴,也可以在通入氯气的过程中不断搅拌,以达到降温目的;
故答案是:将装置C中的三颈烧瓶放在冰水浴;在通入氯气的过程中不断搅拌;
(5)根据信息可知,碱性环境下,FeO42-发生氧化还原反应,产生Fe(OH)3胶体,具有较强的吸附作用,能够净水;离子方程式为:4FeO42-+10H2O=4Fe(OH)3+3O2↑+8OH-;
故答案是:4FeO42-+10H2O=4Fe(OH)
(6)i.方案Ⅰ中加入KSCN溶液至过量,溶液呈红色,说明反应后溶液中含有Fe3+;根据题干资料信息:K2FeO4在酸性溶液中快速产生O2,自身会转化为Fe3+;离子方程式为4FeO42-+20H+=4Fe3++3O2↑+10H2O;
故答案是:Fe3+;4FeO42-+20H+=4Fe3++3O2↑+10H2O;
(7)K2FeO4晶体在碱性条件下较稳定,使用KOH溶液洗涤可以使K2FeO4稳定析出,同时K2FeO4固体表面可能吸附ClO-,ClO-在酸性条件下可与Cl-反应生成Cl2,从而干扰实验,因此用KOH溶液洗涤的目的是:使K2FeO4稳定溶出,同时洗去K2FeO4固体表面吸附的ClO-,防止ClO-与Cl-在酸性条件下反应产生Cl2,干扰实验;
故答案是:使K2FeO4稳定溶出,并把K2FeO4表面吸附的ClO-除尽,防止ClO-与Cl-在酸性条件下反应产生Cl2,避免ClO-干扰实验;
(8)K2FeO4的制备实验中,Fe(OH)3在碱性条件下被Cl2氧化为FeO42-,Cl2为氧化剂,FeO42-为氧化产物,氧化剂的氧化性强于氧化产物的氧化性,则Cl2的氧化性强于FeO42-;而方案Ⅱ中,FeO42-在酸性条件下氧化Cl-生成Cl2,FeO42-为氧化剂,Cl2为氧化产物,则FeO42-的氧化性强于Cl2;氧化性强弱关系相反的原因是两个反应体系的酸碱性不同,因此溶液的酸碱性会影响物质的氧化性的强弱。
故答案是:>;溶液酸碱性不同;
(9)向含有FeO42-溶液滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,FeO42-在过量酸的作用下完全转化为Fe3+和O2,溶液浅紫色一定是MnO42-的颜色,故能说明氧化性FeO42->MnO42-;由于K2FeO4为紫色固体,若向含有FeO42-溶液滴入MnSO4和足量H2SO4的混合溶液中,若观察到溶液的颜色仍为浅紫色;若二者没有发生反应,则氧化性:FeO42-<MnO42-;
故答案是:能说明;FeO42-在过量酸的作用下完全转化为Fe3+和O2,溶液浅紫色一定是MnO42-的颜色;不能说明,向紫色溶液b中滴加过量稀硫酸,观察溶液紫色快速褪去还是显浅紫色。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,H2(g)与I2(g)反应生成HI(g),反应的能量变化如下图所示。下列说法不正确的是

A.H2(g)+I2(g)=2HI(g) ΔH=-13kJ·mol1
B.反应物的总能量比生成物的总能量高
C.H2(g)和I2(g)的总能量比HI(g)的能量高13kJ
D.断裂反应物中化学键吸收的总能量比形成生成物中化学键放出的总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)重整制取H2,具有无毒、无刺激性等优点。回答下列问题:
(1) CH3OCH3和O2发生反应I:CH3OCH3(g)+![]() O2(g)=2CO(g)+3H2(g)△H
O2(g)=2CO(g)+3H2(g)△H
已知:CH3OCH3(g)![]() CO(g)+H2(g)+CH4(g)△H1
CO(g)+H2(g)+CH4(g)△H1
CH4(g)+![]() O2(g)=CO(g)+2H2O (g)△H2
O2(g)=CO(g)+2H2O (g)△H2
H2(g)+![]() O2(g)=H2O (g)△H3
O2(g)=H2O (g)△H3
①则反应I的△H=____________________(用含△H1、△H2、△H3的代数式表示)。
②保持温度和压强不变,分别按不同进料比通入CH3OCH3和O2,发生反应I。测得平衡时H2的体积百分含量与进料气中n(O2)/n(CH3OCH3)的关系如图所示。当![]() >0.6时,H2的体积百分含量快速降低,其主要原因是____(填标号)。
>0.6时,H2的体积百分含量快速降低,其主要原因是____(填标号)。

A.过量的O2起稀释作用
B.过量的O2与H2发生副反应生成H2O
C.![]() >0.6平衡向逆反应方向移动
>0.6平衡向逆反应方向移动
(2)T℃时,在恒容密闭容器中通入CH3OCH3,发生反应II:CH3OCH3(g)![]() CO(g)+H2(g)+CH4(g),测得容器内初始压强为41.6 kPa,反应过程中反应速率v(CH3OCH3)时间t与CH3OCH3分压P(CH3OCH3)的关系如图所示。
CO(g)+H2(g)+CH4(g),测得容器内初始压强为41.6 kPa,反应过程中反应速率v(CH3OCH3)时间t与CH3OCH3分压P(CH3OCH3)的关系如图所示。

①t=400 s时,CH3OCH3的转化率为________(保留2位有效数字);反应速率满足v(CH3OCH3)=kPn(CH3OCH3),k=_________s-1;400 s时v(CH3OCH3)=_________kPas-1。
②达到平衡时,测得体系的总压强P总= 121.6 kPa,则该反应的平衡常数Kp=________________kPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③该温度下,要缩短达到平衡所需的时间,除改进催化剂外,还可采取的措施是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化合物X的叙述正确的是( )

A.X分子能发生氧化、取代、消去反应B.X分子只存在2个手性碳原子
C.X分子中含有五种官能团D.1 mol X与足量NaOH溶液反应,最多消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150 mL 4 mol·L-1的稀硝酸恰好使混合物完全溶解,放出2.24 L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
A. 0.21 mol B. 0.25 mol C. 0.3 mol D. 0.35 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素及其化合物的用途非常广泛。回答下列问题:
(1)基态氯原子价电子轨道表示式(电子排布图)为___;处于最高能级电子云轮廓图形状为____。
(2)![]() 和
和![]() 的中心原子相同且杂化方式也相同,它们的键长和键角如下图所示:
的中心原子相同且杂化方式也相同,它们的键长和键角如下图所示:
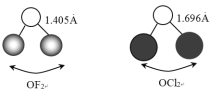
①O-F键的键长比O-Cl键的小,其原因是______。
②键角:∠FOF_____(填“>”、“<”或“=”)∠ClOCl。
(3)①试解释酸性HBrO4>HBrO3的原因_________。
②试解释酸性HClO3>HBrO3>HIO3的原因_________。
(4)![]() 的熔点为1040℃;
的熔点为1040℃;![]() 的熔点为194℃,沸点为181℃,前者的熔点比后者高得多,其原因是______。
的熔点为194℃,沸点为181℃,前者的熔点比后者高得多,其原因是______。
(5)氯化亚铜晶胞结构如图所示,晶胞参数a=0.542nm。
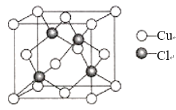
①Cu+的配位数为_____。
②氯化亚铜的密度为____![]() (用含NA的计算式表示)。
(用含NA的计算式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100℃时,将0.100mol的N2O4气体充入1L抽空密闭容器中,发生反应:N2O4(g)2NO2.现在隔一定时间对该容器内的物质进行分析,得到如下表格:
t/s c/(molL﹣1) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4)/(molL﹣1) | 0.100 | c1 | 0.050 | c3 | a | b |
c(NO2)/(molL﹣1) | 0 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试回答下列问题:
(1)达到平衡时N2O4的转化率为_____%,表中c2_____c3,a_____b(后两空选填>、<、=)
(2)20 s的N2O4的浓度c1=_____mol/L在0~20s内N2O4的平均反应速率为_____mol/(Ls);
(3)若其他反应条件以及初始物质物质的量不变,将反应的温度降低到80℃时,达到平衡时NO2的物质的量为0.100 mol,那么正反应是_____反应(选填吸热或放热)
(4)若在相同初始情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度为_____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学概念在逻辑上存在如图关系,对下列概念的说法正确的是( )

A. 化合物与氧化物属于交叉关系
B. 单质与非电解质属于包含关系
C. 溶液与分散系属于并列关系
D. 化合物与电解质属于包含关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+3H2(g)![]() 2NH3 (g) △H<0,在某一时间段中反应速率与反应过程的曲线关系如图,t1、t3、t4时刻外界条件有所改变。下列说法正确的是( )
2NH3 (g) △H<0,在某一时间段中反应速率与反应过程的曲线关系如图,t1、t3、t4时刻外界条件有所改变。下列说法正确的是( )

A. t5~t6时氨气的体积分数最大 B. t3时升高了温度
C. t1时加入催化剂 D. t4时减小压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com