
【题目】卤族元素及其化合物的用途非常广泛。回答下列问题:
(1)基态氯原子价电子轨道表示式(电子排布图)为___;处于最高能级电子云轮廓图形状为____。
(2)![]() 和
和![]() 的中心原子相同且杂化方式也相同,它们的键长和键角如下图所示:
的中心原子相同且杂化方式也相同,它们的键长和键角如下图所示:
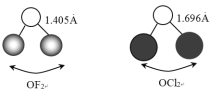
①O-F键的键长比O-Cl键的小,其原因是______。
②键角:∠FOF_____(填“>”、“<”或“=”)∠ClOCl。
(3)①试解释酸性HBrO4>HBrO3的原因_________。
②试解释酸性HClO3>HBrO3>HIO3的原因_________。
(4)![]() 的熔点为1040℃;
的熔点为1040℃;![]() 的熔点为194℃,沸点为181℃,前者的熔点比后者高得多,其原因是______。
的熔点为194℃,沸点为181℃,前者的熔点比后者高得多,其原因是______。
(5)氯化亚铜晶胞结构如图所示,晶胞参数a=0.542nm。
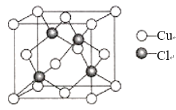
①Cu+的配位数为_____。
②氯化亚铜的密度为____![]() (用含NA的计算式表示)。
(用含NA的计算式表示)。
【答案】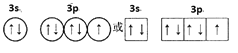 哑铃形(纺锤形) F的原子半径比Cl小,电负性比Cl大 < HBrO3和 HBrO4可分别表示为(HO)BrO2和(HO)BrO3,HBrO3中Br为+5价而HBrO4中Br为+7价。后者正电性更高,导致H、O之间的电子对向O偏移,更易电离出H+。[或非羟基氧个数依次减小(或中心原子价态依次减小)] 中心原子的电负性大小,电负性大的对氧氢键的吸引力就大,于是电子云就会朝氧偏离,从而氢离子就容易脱落,酸性就强。
哑铃形(纺锤形) F的原子半径比Cl小,电负性比Cl大 < HBrO3和 HBrO4可分别表示为(HO)BrO2和(HO)BrO3,HBrO3中Br为+5价而HBrO4中Br为+7价。后者正电性更高,导致H、O之间的电子对向O偏移,更易电离出H+。[或非羟基氧个数依次减小(或中心原子价态依次减小)] 中心原子的电负性大小,电负性大的对氧氢键的吸引力就大,于是电子云就会朝氧偏离,从而氢离子就容易脱落,酸性就强。 ![]() 是离子晶体,
是离子晶体,![]() 是分子晶体 4
是分子晶体 4 ![]()
【解析】
决定键长的因素为原子半径和电负性;决定键角的因素有中心原子的杂化方式、配位原子的电负性、孤对电子等;同一元素不同价态对应的酸,一般化合价越高,导致H、O之间的电子对向O偏移,更易电离出H+,酸性越强(非羟基氧原子数越多酸性越强);元素电负性大的对氧氢键的吸引力就大,于是电子云就会朝氧偏离,从而氢离子就容易脱落,所以对应元素的含氧酸的酸性越强;离子晶体的熔点一般高于分子晶体;晶胞的密度等于质量除以体积,根据均摊法计算每个晶胞含有的离子个数,求每个晶胞的质量,最后得到密度。
(1) 氯原子为17号元素,基态氯原子价电子排布为:3s23p5,轨道表示式(电子排布图)为 ;最高能级为3p,p能级电子云轮廓图形状为哑铃形(纺锤形);
;最高能级为3p,p能级电子云轮廓图形状为哑铃形(纺锤形);
(2)①![]() 和
和![]() 的中心原子均为氧原子,杂化方式均为sp3,决定键长的因素为原子半径和电负性,由于F的原子半径比Cl小,电负性比Cl大,所以O-F键的键长比O-Cl键的小;
的中心原子均为氧原子,杂化方式均为sp3,决定键长的因素为原子半径和电负性,由于F的原子半径比Cl小,电负性比Cl大,所以O-F键的键长比O-Cl键的小;
②由于F的电负性比Cl大,成键电子将偏向F,从而降低成键电子对间的斥力,使得键角:∠FOF<∠ClOCl;
(3)①由于HBrO3和 HBrO4可分别表示为(HO)BrO2和(HO)BrO3,HBrO3中Br为+5价而HBrO4中Br为+7价。后者正电性更高,导致H、O之间的电子对向O偏移,更易电离出H+,所以酸性HBrO4>HBrO3;
②同主族,从上到下,电负性依次减弱,即HClO3、HBrO3、HIO3中心原子的电负性大小Cl>Br>I,电负性大的对氧氢键的吸引力就大,于是电子云就会朝氧偏离,从而氢离子就容易脱落,所以酸性HClO3>HBrO3>HIO3;
(4)氟的电负性大,![]() 的熔点非常高,故
的熔点非常高,故![]() 是离子晶体;
是离子晶体;![]() 的熔点沸点很低,为分子晶体,离子晶体的熔点一般高于分子晶体,所以
的熔点沸点很低,为分子晶体,离子晶体的熔点一般高于分子晶体,所以![]() 的熔点比
的熔点比![]() 高得多;
高得多;
(5)①由图示知,离Cu+的最近的Cl-有4个,Cu+的配位数为4;
②如图,根据均摊法,每个晶胞中含有Cu+![]() ,Cl-有4个,每个晶胞的质量
,Cl-有4个,每个晶胞的质量![]() ,体积
,体积![]() ,根据
,根据![]() ,氯化亚铜的密度为
,氯化亚铜的密度为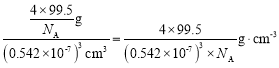 。
。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】NO2 是大气的主要污染物之一,某研究小组设计如图所示的装置对NO2 进行回收利用,装置中a、b均为多孔石墨电极。下列说法正确的是

A. a 为电池的负极,发生还原反应
B. 电子流向:a 电极→用电器→b 电极→溶液→a 电极
C. 一段时间后,b 极附近HNO3浓度增大
D. 电池总反应为4NO2 +O2 +2H2O= 4HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用14.2 g无水硫酸钠配制成500 mL溶液,其物质的量浓度为___ mol·L-1。
(2)若从中取出50 mL,其物质的量浓度为___ mol·L-1;溶质的质量为___ g。
(3)若将这50 mL溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为___ mol·L-1,SO42-的物质的量浓度为___ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是常温钠离子全固态浓差电池工作示意图。正极材料为层状含钠过渡金属氧化物,负极为钠锡合金(Na15Sn4)。下列说法合理的是( )。
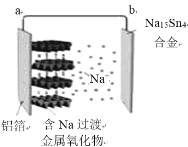
A.该电池工作时不发生氧化还原反应B.放电时,负极的反应为:Na15Sn4-15e-=15Na++4Sn
C.充电时,Na+会被吸附进入过渡金属氧化层D.充电时,a极接电源的负极,b极接电源的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
制备K2FeO4(夹持装置略)
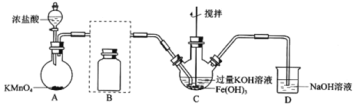
(1)A为氯气发生装置,A中反应离子方程式是:___。
(2)将除杂装置B补充完整并标明所用试剂。___。
(3)C中得到紫色固体和溶液。C中Cl2发生的反应有:3Cl2+2Fe(OH)3+10KOH→2K2FeO4+6KCl+8H2O,另外还有:___。
(4)已知Cl2与KOH在较高温度下反应生成KClO3。为了保证生产KClO,在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是:___、__。
探究K2FeO4的性质
(5)高铁酸钾常用于工业废水与城市生活污水的处理,可用作高效水处理剂,表现在水中与污染物作用的过程中,经过一系列反应,由六价降至三价后,能对水产生净化作用的原因是(结合离子方程式回答):____。
(6)取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2,为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案I | 取少量a,滴加KSCN溶液至过量,溶液呈红色 |
方案II | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生 |
i.由方案I中溶液变红可知a中含有__离子,但该离子的产生不能判断一定K2FeO4将Cl-氧化,还可能由___产生(用离子方程式表示)。
ii.方案II可证明K2FeO4氧化了Cl-。
(7)用KOH溶液洗涤的目的是___。
(8)根据K2FeO4的制备实验得出:氧化性Cl2__FeO42-(填“>”或“<”),而方案II实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是___。
(9)资料表明,酸性溶液中的氧化性FeO42->MnO42-,验证实验如下:
将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性FeO42->MnO42-,若能,请说明理由;若不能,进一步设计实验方案,理由或方案:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当反应L(s)+aG(g) ![]() bR(g)达到平衡后,温度和压强对该反应的影响如图所示,图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断
bR(g)达到平衡后,温度和压强对该反应的影响如图所示,图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断
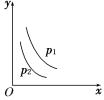
A. 上述反应是放热反应 B. 上述反应是吸热反应
C. a>b D. a<b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课外活动时间玛丽同学制备Fe(OH)3胶体,具体操作如下:首先在烧杯中加入25mL蒸馏水,用酒精灯加热至沸腾,然后向烧杯中逐滴滴加6滴FeCl3饱和溶液,并继续煮沸至液体呈透明的红褐色,即得Fe(OH)3胶体。试回答下列问题:
(1)写出该反应的化学方程式:___。
(2)如何证明玛丽同学是否成功制得胶体_____?
(3)若玛丽同学在滴加FeCl3饱和溶液的同时用玻璃棒不断搅拌,结果没有得到胶体,为什么呢_____?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氢氧化钠、氯化钡和硫酸铝三种固体组成的混合物溶于足量的水中,充分溶解,用1molL﹣1稀硫酸滴定,加入稀硫酸的体积与生成沉淀的质量关系如图所示。下列有关判断正确的是( )
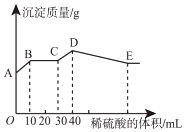
A.B点所表示的沉淀是:Al(OH)3、BaSO4
B.B﹣C段所发生反应的离子方程式是:H++OH﹣→H2O
C.A﹣B段发生反应的离子方程式:Ba2++SO42﹣→BaSO4↓
D.拐点E的横坐标为80mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在空气中,有下列反应发生: ①N2 + O2 = 2NO;②2NO+O2=2NO2;③3NO2 + H2O = 2HNO3 + NO;④ 2SO2+O2 = 2SO3;⑤ SO3 + H2O = H2SO4; ⑥SO2+H2O![]() H2SO3; ⑦3O2 = 2O3,其中属于氧化还原反应的是( )
H2SO3; ⑦3O2 = 2O3,其中属于氧化还原反应的是( )
A. ①②③④ B. ①②③④⑦ C. ①②④⑦ D. ①②③④⑤⑥⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com