
【题目】下列有关化合物X的叙述正确的是( )

A.X分子能发生氧化、取代、消去反应B.X分子只存在2个手性碳原子
C.X分子中含有五种官能团D.1 mol X与足量NaOH溶液反应,最多消耗3 mol NaOH
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学用语正确的是
A.用饱和 Na2CO3 溶液浸泡锅炉水垢除去其中的 CaSO4:CO![]() + CaSO4
+ CaSO4![]() CaCO3 + SO
CaCO3 + SO![]()
B.用白醋和淀粉 KI 试纸检验加碘盐中的 KIO3:5I + IO![]() + 3H2O = 3I2 + 6OH-
+ 3H2O = 3I2 + 6OH-
C.碱性条件下,用 KClO 溶液与 Fe(OH)3 反应制备新型净水剂 K2FeO4: 3ClO + 2Fe(OH)3 = 2FeO![]() + 3Cl + 4H+ + H2O
+ 3Cl + 4H+ + H2O
D.氯碱工业制备氯气:2Cl + 2H+ ![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2(g) ![]() N2O4(g) ΔH<0)
N2O4(g) ΔH<0)
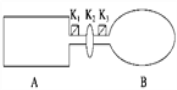
(1)一段时间后,反应达到平衡,此时A、B中生成N2O4的速率是vA______vB(填“>”、“<”或“=”);若打开活塞K2,气球B将______(填“变大”、“变小”或“不变”).
(2)关闭活塞K2,若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将________(填“增大”、“减小”或“不变”);若分别通入等量的氖气,则达到平衡时,A中NO2的转化率将________,B中NO2的转化率将______(填“变大”、“变小”或“不变”).
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,______中的颜色较深.
(4)若在容器A中充入4.6 g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用14.2 g无水硫酸钠配制成500 mL溶液,其物质的量浓度为___ mol·L-1。
(2)若从中取出50 mL,其物质的量浓度为___ mol·L-1;溶质的质量为___ g。
(3)若将这50 mL溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为___ mol·L-1,SO42-的物质的量浓度为___ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,pH=2的两种一元酸x和y,体积均为100mL,稀释过程中pH与溶液体积的关系如图所示。分别滴加NaOH溶液至滴定终点,消耗NaOH溶液的体积为Vx、Vy,则

A.x为弱酸,Vx<VyB.x为强酸,Vx>Vy
C.y为弱酸,Vx<VyD.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是常温钠离子全固态浓差电池工作示意图。正极材料为层状含钠过渡金属氧化物,负极为钠锡合金(Na15Sn4)。下列说法合理的是( )。
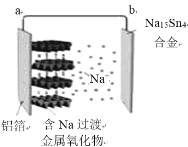
A.该电池工作时不发生氧化还原反应B.放电时,负极的反应为:Na15Sn4-15e-=15Na++4Sn
C.充电时,Na+会被吸附进入过渡金属氧化层D.充电时,a极接电源的负极,b极接电源的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
制备K2FeO4(夹持装置略)
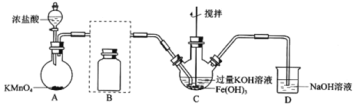
(1)A为氯气发生装置,A中反应离子方程式是:___。
(2)将除杂装置B补充完整并标明所用试剂。___。
(3)C中得到紫色固体和溶液。C中Cl2发生的反应有:3Cl2+2Fe(OH)3+10KOH→2K2FeO4+6KCl+8H2O,另外还有:___。
(4)已知Cl2与KOH在较高温度下反应生成KClO3。为了保证生产KClO,在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是:___、__。
探究K2FeO4的性质
(5)高铁酸钾常用于工业废水与城市生活污水的处理,可用作高效水处理剂,表现在水中与污染物作用的过程中,经过一系列反应,由六价降至三价后,能对水产生净化作用的原因是(结合离子方程式回答):____。
(6)取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2,为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案I | 取少量a,滴加KSCN溶液至过量,溶液呈红色 |
方案II | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生 |
i.由方案I中溶液变红可知a中含有__离子,但该离子的产生不能判断一定K2FeO4将Cl-氧化,还可能由___产生(用离子方程式表示)。
ii.方案II可证明K2FeO4氧化了Cl-。
(7)用KOH溶液洗涤的目的是___。
(8)根据K2FeO4的制备实验得出:氧化性Cl2__FeO42-(填“>”或“<”),而方案II实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是___。
(9)资料表明,酸性溶液中的氧化性FeO42->MnO42-,验证实验如下:
将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性FeO42->MnO42-,若能,请说明理由;若不能,进一步设计实验方案,理由或方案:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课外活动时间玛丽同学制备Fe(OH)3胶体,具体操作如下:首先在烧杯中加入25mL蒸馏水,用酒精灯加热至沸腾,然后向烧杯中逐滴滴加6滴FeCl3饱和溶液,并继续煮沸至液体呈透明的红褐色,即得Fe(OH)3胶体。试回答下列问题:
(1)写出该反应的化学方程式:___。
(2)如何证明玛丽同学是否成功制得胶体_____?
(3)若玛丽同学在滴加FeCl3饱和溶液的同时用玻璃棒不断搅拌,结果没有得到胶体,为什么呢_____?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]俗称莫尔盐,其摩尔质量为392 g/mol,可溶于水,在100℃~ 110 ℃时分解。为探究其化学组成,甲乙两同学设计了如下实验。
Ⅰ.探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如下图所示的装置进行实验,装置C中可观察到的现象是溶液变红,由此可知分解产物中有_____________。

(2)乙同学认为莫尔盐晶体分解的产物中还含有SO3(g)、SO2(g)及N2(g)。为验证产物的存在,用下列装置进行实验:

①乙组同学的实验中,装置依次连接的合理顺序为A→H→__________________________→G
②证明含有SO3的实验现象是_______________。
II.为测硫酸亚铁铵纯度,称取m g 莫尔盐样品,配成500 mL溶液。甲、乙两同学设计了如下两个实验方案。
甲方案:取25.00mL硫酸亚铁铵溶液用0.1000molL-1的酸性K2Cr2O7溶液分三次进行滴定。
乙方案:(通过NH4+测定)设计装置如下图所示。取25.00 mL样品溶液进行该实验。
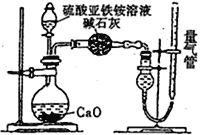
(1)滴定过程中,酸性K2Cr2O7溶液应装在_____________滴定管中。甲方案中的离子方程式为_________________________________。
(2)乙方案中量气管中最佳试剂是______(填字母)。
a.水 b.饱和NaHCO3溶液 c.CC14
(3)乙方案中收集完气体并恢复至室温,读数前应进行的操作是______________________________。
(4)若测得NH3(已折算为标准状况下)为VL,则硫酸亚铁铵纯度为___________。(用含V、m的式子表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com