
【题目】(1)通常用饱和NaHCO3溶液除去混在CO2中的少量HCl气体,其反应的离子方程式为 ;也不能用Na2CO3溶液吸收的原因是 (用离子方程表示)。
(2)向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
①写出反应的离子方程式_______________________。
②下列三种情况下,离子方程式与相同的是______________(填序号)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
③若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用如图1中的 (填序号)曲线表示。
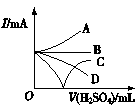

图1 图2
④若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图2所示。向该烧杯中缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将 。
【答案】(1)H++HCO3-=H2O+CO2↑;CO2+CO32-+H2O=2HCO3-
(2)①Ba2++2OH-+2H+SO42-=BaSO4↓+2H2O②A③C④下沉
【解析】
试题分析:(1)用饱和NaHCO3溶液除去混在CO2中的少量HCl气体,其反应的离子方程式为:H+ + HCO3- =H2O+ CO2↑;由于CO2 + CO32- + H2O = 2HCO3-,所以不能用Na2CO3溶液吸收。
(2)①向Ba(OH)2溶液中逐滴加入稀硫酸,该反应的离子方程式为:Ba2++2OH-+2H+SO42-=BaSO4↓+2H2O。
②A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液显中性,反应的离子方程式为:Ba2+ + 2OH- + 2H + SO42- = BaSO4↓ + 2H2O,与①同;B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀,离子方程式为:Ba2++OH-+H+SO42-=BaSO4↓+H2O,与①不同;C.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量,反应的离子方程式为:Ba2++OH-+H+SO42-=BaSO4↓+H2O,与①不同。故答案为:A;
③向Ba(OH)2溶液中缓缓加入稀硫酸,当Ba(OH)2与H2SO4恰好完全反应时,溶液导电能力为零,再加稀硫酸至过量,溶液导电能力又增强,故曲线C正确。故答案为:C;
④当Ba(OH)2与H2SO4恰好完全反应时,溶液密度变小,塑料小球下沉。故答案为:下沉。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是:( )
A.在高温条件下,C能置换Si02中的Si,说明C的非金属性比Si强
B.单质硅是将太阳能转化为电能的常用材料
C.熔融烧碱不能使用石英坩埚和陶瓷坩埚
D.置换反应一定是氧化还原反应,不一定是离子反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产和生活密切相关,下列说法正确的是( )
A. 聚乙烯塑料的老化是因为发生了加成反应
B. 农业上为了提高粮食的产量应大量使用化肥
C. 合成纤维、人造纤维及碳纤维都属于有机高分子材料
D. 利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于氧化还原反应的是( )
A.2F2+2H2O=4HF+O2 B.Cl2+H2O=HCl+HClO
C.BrCl+H2O=HCl+HBrO D.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的分子数比乙的分子数多
B.甲的摩尔体积比乙的摩尔体积小
C.甲的物质的量比乙的物质的量少
D.甲的相对分子质量比乙的相对分子质量小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在科研和生产中有广泛应用
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。
C(s)+H2O(g)![]() H2(g)+CO(g)ΔH=+131.3 kJ·mol-1,ΔS=+133.7 J·mol-1·K-1,
H2(g)+CO(g)ΔH=+131.3 kJ·mol-1,ΔS=+133.7 J·mol-1·K-1,
该反应在低温下________(填“能”或“不能”)自发进行。
(2)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应
TaS2(s)+2I2(g)![]() TaI4(g)+S2(g)△H﹥0 (I)
TaI4(g)+S2(g)△H﹥0 (I)
反应(I)的平衡常数表达式K= ,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为
(3)已知在400 ℃时,N2(g)+3H2(g)![]() 2NH3(g)的K=0.5。
2NH3(g)的K=0.5。
①在400 ℃时,2NH3(g)![]() N2(g)+3H2(g)的K′=___________(填数值)。
N2(g)+3H2(g)的K′=___________(填数值)。
②400 ℃时,在0.5 L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2 mol、1 mol、2 mol,则此时反应v(N2)正___________(填“>”“<”“=”或“不确定”)v(N2)逆。
(4) 离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl![]() 和AlCl
和AlCl![]() 组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品接电源的___________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为________________。为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为________mol。
组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品接电源的___________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为________________。为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. Na与H2O的反应是熵增的放热反应,该反应能自发进行
B. 放热反应的反应速率总是大于吸热反应的反应速率
C. 增大压强会加快化学反应速率,其原因是增加了活化分子的百分率
D. 强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com