
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的分子数比乙的分子数多
B.甲的摩尔体积比乙的摩尔体积小
C.甲的物质的量比乙的物质的量少
D.甲的相对分子质量比乙的相对分子质量小
科目:高中化学 来源: 题型:
【题目】下列各基态原子的电子排布式正确的是( )
①Be:1s22s12p1 ②O:1s22s22p4
③He:1s12s1 ④Cl:1s22s22p63s23p5
A. ①② B. ②③
C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l);
电解池:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成1molAl2O3 |
C | 正极:PbO2+4H++2e—=Pb2++2H2O | 阳极:2Al+3H2O-6e—=Al2O3+6H+ |
D |
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)由金红石TiO2制取单质Ti,涉及到的步骤为:
TiO2![]() TiCl4
TiCl4![]() Ti
Ti
已知:① Cs+O2g=CO2g; H=3935 kJ·mol1
② 2COg+O2g=2CO2g; H=566 kJ·mol1
③ TiO2s+2Cl2g=TiCl4s+O2g; H=+141 kJ·mol1
则TiO2s+2Cl2g+2Cs=TiCl4s+2COg的H= 。
(2)已知:①Zn(s)+1/2 O2(g)=ZnO(s);ΔH=-348.3 kJ/mol
②Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s);ΔH=-317.3 kJ/mol
则1 mol Ag(s)和足量O2(g)完全反应生成Ag2O(s)时,放出的热量为 kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)通常用饱和NaHCO3溶液除去混在CO2中的少量HCl气体,其反应的离子方程式为 ;也不能用Na2CO3溶液吸收的原因是 (用离子方程表示)。
(2)向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
①写出反应的离子方程式_______________________。
②下列三种情况下,离子方程式与相同的是______________(填序号)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
③若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用如图1中的 (填序号)曲线表示。
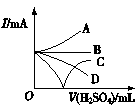

图1 图2
④若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图2所示。向该烧杯中缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用原子最外层电子排布式表示的各对元素中,能形成离子化合物的是( )
A. 3s23p3和2S22p2 B. 3s2和4S24p5
C. 1s1和3s23p4 D. 2S22p2和2S22p4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种短周期元素X和Y可组成化合物XY3,在Y的原子序数为m时,X的原子序数为:①m-4 ②m+4 ③m+8 ④m-2 ⑤m+6.其中正确的组合是
A.①②④ B.①②③④⑤ C.①②③⑤ D.①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】量取100 mL碘的饱和水溶液,倒入分液漏斗中,然后再注入4 mL四氯化碳,用力振荡后静置,实验现象为( )
A. 液体分层,上层为四氯化碳层,黄色 B. 液体分层,上层为水层,紫色
C. 液体分层,下层为四氯化碳层,紫色 D. 液体分层,下层为水层,黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德常数,下列说法正确的是( )
A.0.1 mol/L Na2CO3溶液中含有0.2 mol Na+
B.在常温常压下,11.2 L氮气所含的原子数目为NA
C.2 g氢气所含原子数目为NA
D.在常温常压下,18 g水中含有的分子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com