
【题目】化学反应原理在科研和生产中有广泛应用
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。
C(s)+H2O(g)![]() H2(g)+CO(g)ΔH=+131.3 kJ·mol-1,ΔS=+133.7 J·mol-1·K-1,
H2(g)+CO(g)ΔH=+131.3 kJ·mol-1,ΔS=+133.7 J·mol-1·K-1,
该反应在低温下________(填“能”或“不能”)自发进行。
(2)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应
TaS2(s)+2I2(g)![]() TaI4(g)+S2(g)△H﹥0 (I)
TaI4(g)+S2(g)△H﹥0 (I)
反应(I)的平衡常数表达式K= ,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为
(3)已知在400 ℃时,N2(g)+3H2(g)![]() 2NH3(g)的K=0.5。
2NH3(g)的K=0.5。
①在400 ℃时,2NH3(g)![]() N2(g)+3H2(g)的K′=___________(填数值)。
N2(g)+3H2(g)的K′=___________(填数值)。
②400 ℃时,在0.5 L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2 mol、1 mol、2 mol,则此时反应v(N2)正___________(填“>”“<”“=”或“不确定”)v(N2)逆。
(4) 离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl![]() 和AlCl
和AlCl![]() 组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品接电源的___________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为________________。为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为________mol。
组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品接电源的___________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为________________。为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为________mol。
【答案】(1)不能;(2)![]() 或
或![]() ,66.7%;
,66.7%;
(3)①2;②=;(4)负,4Al2Cl![]() +3e-===Al+7AlCl
+3e-===Al+7AlCl![]() ,3。
,3。
【解析】
试题分析:(1)根据△G=△H-T△S,自发进行△G<0,根据反应方程式,△H>0,△S>0,因此低温下,不能自发进行;(2)根据平衡常数的定义,K=c(S2)×c(TaCl4)/c2(I2),
TaS2(s)+2I2(g)![]() TaI4(g)+S2(g)
TaI4(g)+S2(g)
起始: 1 0 0
变化: 2x x x
平衡: 1-2x x x
因为恒容状态,设容积的体积为1L,x2/(1-2x)2=1,解得x=1/3,则I2的转化率为2×1/(3×1)×100%=66.7%;(3)①N2(g)+3H2(g)![]() 2NH3(g)的K=c2(NH3)/[c(N2)×c3(H2)],2NH3(g)
2NH3(g)的K=c2(NH3)/[c(N2)×c3(H2)],2NH3(g)![]() N2(g)+3H2(g),K′=[c(N2)×c3(H2)]/ c2(NH3)=1/K=2;②此时的浓度商为:(2/0.5)2/[(2/0.5)×(1/0.5)3]=0.5=K,说明此反应达到平衡,即v(N2)正=v(N2)逆;(4)电镀原理,钢制品不参与反应,作阴极,与电源的负极相连,阴极反应得到电子,因为是钢制品镀铝单质,因此是4Al2Cl7-+3e-=Al+7AlCl4-,2Al+2OH-+2H2O=2AlO2-+3H2↑,氢气是还原产物,此反应中转移6mole-,得到3molH2。
N2(g)+3H2(g),K′=[c(N2)×c3(H2)]/ c2(NH3)=1/K=2;②此时的浓度商为:(2/0.5)2/[(2/0.5)×(1/0.5)3]=0.5=K,说明此反应达到平衡,即v(N2)正=v(N2)逆;(4)电镀原理,钢制品不参与反应,作阴极,与电源的负极相连,阴极反应得到电子,因为是钢制品镀铝单质,因此是4Al2Cl7-+3e-=Al+7AlCl4-,2Al+2OH-+2H2O=2AlO2-+3H2↑,氢气是还原产物,此反应中转移6mole-,得到3molH2。


科目:高中化学 来源: 题型:
【题目】软锰矿的主要成分为MnO2,工业可用其按如下方法制备高锰酸钾:

A.将软锰矿初选后粉碎,与固体苛性钾混合,加入反应釜中敞口加热至熔融,并保持熔融状态下搅拌25~30min,冷却得墨绿色熔渣(主要成分为K2MnO4);
B.将熔渣粉碎,加入去离子水溶解,充分搅拌后过滤得墨绿色滤液1;
C.取适量70%硫酸,加入滤液1中,边加边搅拌,直至不再产生棕褐色沉淀,过滤,得紫色滤液2;
d.提纯滤液2即可得高锰酸钾粗品。
根据上述内容回答下列问题:
(1)步骤a中,反应物熔融状态下搅拌的目的是: ,用化学方程式表示出MnO2转化为K2MnO4的反应原理: 。
(2)粉碎后的软锰矿与苛性钾置于 中进行加热。
A.陶瓷反应釜 B.石英反应釜 C.铁制反应釜
(3)写出步骤c中反应的离子方程式: 。
(4)步骤d中由滤液2得到高锰酸钾粗品的主要操作步骤是:加热浓缩、冷却结晶、过滤、____________、干燥。该操作为如何进行___________________。
(5)若将母液循环使用,可能造成的问题是: 。
(6)早先有文献报道:步骤a中加入KClO3固体会缩短流程时间以及提高高锰酸钾的产率,但从绿色化学角度考虑后,现在工厂中一般不采用此法,你认为这种方法不符合绿色化学的原因是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中,所得溶液的密度为ρ g/ml,质量分数为ω,物质浓度为c mol/L,则下列关系中正确的是( )
A.c=![]()
B.ω=![]()
C.ω=![]()
D.ρ=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)通常用饱和NaHCO3溶液除去混在CO2中的少量HCl气体,其反应的离子方程式为 ;也不能用Na2CO3溶液吸收的原因是 (用离子方程表示)。
(2)向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
①写出反应的离子方程式_______________________。
②下列三种情况下,离子方程式与相同的是______________(填序号)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
③若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用如图1中的 (填序号)曲线表示。
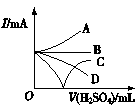

图1 图2
④若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图2所示。向该烧杯中缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)。一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是( )
SO3(g)+NO(g)。一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是( )
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1 mol SO3的同时生成1 mol NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种短周期元素X和Y可组成化合物XY3,在Y的原子序数为m时,X的原子序数为:①m-4 ②m+4 ③m+8 ④m-2 ⑤m+6.其中正确的组合是
A.①②④ B.①②③④⑤ C.①②③⑤ D.①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某两种气态烃的1L混合气体,完全燃烧生成1.4LCO2(g)和2LH2O(g),体积均在相同的情况下测得,该混合物可能是( )
A. C2H6 C2H4 B. CH4 C2H4 C. CH4 C3H6 D. C2H6 C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质既能跟稀盐酸反应,又能跟氢氧化钠反应且属于两性化合物的是( )
①碳酸氢钠 ②氧化铝 ③氢氧化铝 ④铝 ⑤氨基酸 ⑥蛋白质
A. 全部 B. ①②③ C. ②③⑤⑥ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 制氢弹用到的D、T互为同位素 B. 苛性钠溶液可用于治疗胃酸过多
C. 硅胶可防止月饼等食品氧化变质 D. 向海水中加入净水剂明矾可以使海水淡化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com