
【题目】25℃时,有体积相同的四种溶液:①pH=3的CH3COOH溶液 ②pH=3的盐酸 ③pH=11的氨水 ④pH=11的NaOH溶液。下列说法不正确的是( )
A. 若将四种溶液稀释100倍,稀释后溶液pH大小顺序:③>④>②>①
B. 等体积的②和③混合生成强酸弱碱盐,混合后溶液呈酸性
C. 等体积的③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③>④
D. 等体积的①和②分别与足量的锌粒反应生成的氢气在同温同压下体积:①>②
【答案】B
【解析】
本题考查弱电解质的电离平衡,溶液中的pH计算及酸性强弱的比较,溶液的稀释对电离平衡的影响以及溶液的酸碱性的判断,难度较大。
pH=3的CH3COOH溶液中c(CH3COOH) >10-3 mol·L-1 , pH=3的盐酸中c(HCl) =10-3 mol·L-1, pH=11的氨水中c(NH3·H2O) >10-3 mol·L-1,pH=11的NaOH溶液中c(NaOH) =10-3 mol·L-1
A.若将四种溶液稀释100倍,弱电解质的pH变化较小,碱溶液的pH大于酸溶液,则稀释后溶液pH大小顺序为:③>④>②>①,A项错误;
B. 等体积的②和③混合生成强酸弱碱盐,氨水为弱碱,碱的物质的量远远大于酸的物质的量,所以所得混合溶液呈碱性,其pH大于7,B项正确;
C.c(NH3·H2O) > c(NaOH)所以等体积的③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③>④,C项错误;
D.醋酸为弱酸,则c(CH3COOH) > c(HCl),等体积的①和②分别与足量镁粉反应,生成![]() 的量①>②,D项错误;
的量①>②,D项错误;


科目:高中化学 来源: 题型:
【题目】下列过程中所发生的化学变化属于加成反应的是( )
A.光照射下甲烷与氯气的混合气体
B.在催化剂作用下,苯与液溴反应生成溴苯
C.乙烯通入溴的四氯化碳溶液中
D.在浓硫酸作用下,苯在50~60℃与浓硝酸发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 标准状况下,1molHF的体积是22.4L
B. 一定条件下某气体的体积是22.4L,则该条件是0℃、101KPa
C. 100ml 2.5mol/L的Al2(SO4)3溶液中c(SO42-) 大于50ml 2.5mol/L的Al2(SO4)3溶液中c(SO42-)
D. V L硫酸铝溶液中含Al3+的质量为m g,则溶液中SO42-的浓度为![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,浓度都是1 mol·L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z。反应2 min后,测得参加反应的X2为0.6 mol·L-1,用Y2的变化表示的反应速率v(Y2)=0.1 mol·L-1· min-1,生成的c(Z)为0.4 mol·L-1,则该反应的化学方程式是
A. X2+2Y2![]() 2XY2 B. 3X2+Y2
2XY2 B. 3X2+Y2![]() 2X3Y
2X3Y
C. X2+3Y2![]() 2XY3 D. 2X2+Y2
2XY3 D. 2X2+Y2![]() 2X2Y
2X2Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,“二氧化碳是否在有水存在时,才能与过氧化钠反应?”这个问题可通过以下实验加以证明。

(1)按图装置,在干燥的试管Ⅲ中装入Na2O2后,在通入CO2之前,应事先将活塞(K1、K2)关闭好,目的是____________
(2)试管Ⅰ内的试剂X是________时,打开活塞K1、K2,加热试管Ⅲ约5分钟后,将带火星的小木条插入试管Ⅱ的液面上,可观察到带火星的小木条不能剧烈地燃烧起来,且Ⅲ内淡黄色粉末未发生变化。则所得的结论是____________________
(3)试管Ⅰ内试剂为CO2饱和水溶液时,其它操作同(2),通过________的现象,可以证明Na2O2与潮湿的CO2能反应且放出O2。
(4)写出 Na2O2与CO2反应的化学方程式___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料。
①以尿素为原料在一定条件下发生反应:
CO(NH2)2(s)+H2O(l)![]() 2NH3(g)+CO2(g)△H=+133.6 kJ/mol。关于该反应的下列说法正确的是____________________(填序号)。
2NH3(g)+CO2(g)△H=+133.6 kJ/mol。关于该反应的下列说法正确的是____________________(填序号)。
a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度使尿素的转化率增大
d. 缩小容器的体积,平衡向逆反应方向移动,达新平衡时NH3的浓度大于原平衡
②尿素在一定条件下可将氮的氧化物还原为氮气。
已知:
再结合①中的信息,则反应2CO(NH2)2(s)+6NO(g)![]() 5N2(g)+2CO2(g)+4H2O(l)的△H =_______kJ/mol。
5N2(g)+2CO2(g)+4H2O(l)的△H =_______kJ/mol。
③密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量随时间变化关系如图所示。则a点的正反应速率v正(CO2)______b点的逆反应速率v逆(CO2)(填“>”、“=”或“<”);氨气的平衡转化率为________________。
CO(NH2)2(s)+H2O(g),混合气体中NH3的物质的量百分含量随时间变化关系如图所示。则a点的正反应速率v正(CO2)______b点的逆反应速率v逆(CO2)(填“>”、“=”或“<”);氨气的平衡转化率为________________。

(2)NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2。已知9.2g NO2和Na2CO3溶液完全反应时转移电子0.1mol,此反应的离子方程式为_________;恰好反应后,使溶液中的CO2完全逸出,所得溶液呈弱碱性,则溶液中离子浓度大小关系是c(Na+)>______。
(3)用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度来制备纳米Cu2O,装置如图所示:

上述装置中B电极应连电极__(填“C”或“D”)。该电解池中的离子交换膜为__(填“阴”或“阳”)离子交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、S和Cl元素的单质及化合物在工业生产中的有效利用备受关注。请回答下列问题:
(1)已知:I.2SO2(g)+O2(g)+2H2O(1) =2H2SO4(aq) △H1;
Ⅱ.Cl2(g)+H2O(1)![]() HCl(aq)+HClO(aq) △H2;
HCl(aq)+HClO(aq) △H2;
Ⅲ.2HClO(aq) =2HCl(aq)+O2(g) △H3
SO2(g)+Cl2(g)+2H2O(1)=2HCl(aq)+H2SO4 (aq) △H4=__________(用含有△H1、△H2和△H3的代数式表示)。
(2)25℃时,H2SO3溶液中各含硫微粒的物质的量分数(δ)与溶液pH的变化关系如图所示。
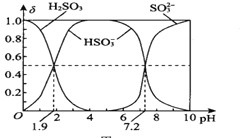
已知25℃时,NaHSO3的水溶液pH<7,用图中的数据通过计算解释原因 ____________________。
(3)利用“ Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“ Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
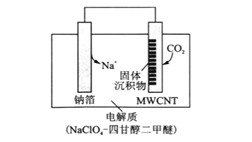
①放电时,正极的电极反应式为______。
②选用高氯酸钠—四甘醇二甲醚做电解液的优点是_______(至少写两点)。
(4)氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂。
①一氯胺(NH2Cl)的电子式为_______。一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生水解,生成具有强烈杀菌作用的物质,该反应的化学方程式为_______。
②在恒温条件下,2molCl2和1molNH3发生反应2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
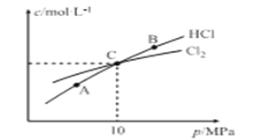
计算C点时该反应的压强平衡常数Kp(C)= _______ (Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国地大物博、资源丰富,其中山西的煤、大庆的石油,四川的天然气较为出名。下列有关化石能源叙述正确的是
A.煤的干馏为化学变化B.汽油为纯净物
C.天然气为二次能源D.裂化的目的是提高乙烯产量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com