
【题目】我国地大物博、资源丰富,其中山西的煤、大庆的石油,四川的天然气较为出名。下列有关化石能源叙述正确的是
A.煤的干馏为化学变化B.汽油为纯净物
C.天然气为二次能源D.裂化的目的是提高乙烯产量
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】25℃时,有体积相同的四种溶液:①pH=3的CH3COOH溶液 ②pH=3的盐酸 ③pH=11的氨水 ④pH=11的NaOH溶液。下列说法不正确的是( )
A. 若将四种溶液稀释100倍,稀释后溶液pH大小顺序:③>④>②>①
B. 等体积的②和③混合生成强酸弱碱盐,混合后溶液呈酸性
C. 等体积的③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③>④
D. 等体积的①和②分别与足量的锌粒反应生成的氢气在同温同压下体积:①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CO2、CO、CH4组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2、CH4、CO的体积比可为( )
A.11∶4∶7B.3∶4∶1C.4∶3∶7D.3∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是 ( )
A. 石灰石与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
B. 钠与水的反应 :![]()
C. 氢氧化铜溶于盐酸:Cu2++2OH-+2H+=Cu2++2H2O
D. 氯气与水的反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中常见的荧光棒的发光原理可用下式表示,上述反应产生的能量传递给荧光染料分子后,使染料分子释放出荧光。下列说法正确的是

A. 上述反应是酯的水解反应
B. 荧光棒发光过程涉及化学能到光能的转化
C. 二苯基草酸酯核磁共振氢谱有4个吸收峰
D. 二苯基草酸酯与草酸![]() 互为同系物
互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料。
(1)氯气和石灰乳反应可以制得漂白粉,漂白粉暴露在空气中因吸收了空气中的CO2和H2O而失效,漂白粉失效过程的化学反应方程式为:______。
(2)氯水中含有多种成分,因而具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空(a、b、c、d中重合部分代表物质间反应,且氯水足量)。

①c过程的反应的离子方程式______,e过程中的离子方程式为 _______。
②d过程所观察到的现象为:____,原因: ____,b过程的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用高浓度含砷废水(主要成分为H3AsO3)制取As2O3的工艺流程如下图所示。
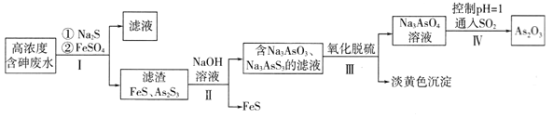
已知:As2S3(s)+3S2-(aq)![]() 2AsS33-(aq)
2AsS33-(aq)
(1)H3AsO3中As元素的化合价为______;H3AsO3的第一步电离方程式为:________。
(2)步骤I加入FeSO4的作用是______________________。
(3)步骤Ⅱ发生反应的化学方程式为___________________。步骤III“氧化脱硫”过程中被氧化的元素是___________(填元素符号)。
(4)步骤IV发生反应的离子方程式为________________________。
(5)利用反应AsO43-+2I-+2H+![]() AsO33-+I2+H2O设计成原电池,起始时在甲、乙两池中分别加入图示药品并连接装置(a、b均为石墨电极)。
AsO33-+I2+H2O设计成原电池,起始时在甲、乙两池中分别加入图示药品并连接装置(a、b均为石墨电极)。
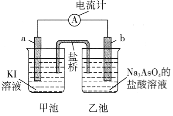
①起始时,b电极的电极反应式为__________________。
②一段时间后电流计指针不发生偏转。欲使指针偏转方向与起始时相反,可采取的措施是______________________________(举一例)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2NO(g)+2H2(g)![]() N2(g)+2H2O(g) △H=-752kJ·mol-1的反应机理如下:
N2(g)+2H2O(g) △H=-752kJ·mol-1的反应机理如下:
①2NO(g)![]() N2O2(g) (快)
N2O2(g) (快)
②N2O2(g)+H2(g)![]() N2O(g)+H2O(g) (慢)
N2O(g)+H2O(g) (慢)
③N2O(g)+H2(g)![]() N2(g)+H2O(g) (快)
N2(g)+H2O(g) (快)
下列有关说法错误的是
A. ①的逆反应速率大于②的正反应速率
B. ②中N2O2与H2的碰撞仅部分有效
C. N2O2和N2O是该反应的催化剂
D. 总反应中逆反应的活化能比正反应的活化能大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在)提取中药药剂As2O3.工艺流程如下:
 回答下列问题:
回答下列问题:
(1)“沉砷”中所用Na2S的电子式为_____________。
(2)已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS33- ;“沉砷”中FeSO4的作用是_____。
2AsS33- ;“沉砷”中FeSO4的作用是_____。
(3)“焙烧”过程中由于条件的原因,生成的三氧化二铁中混有四氧化三铁,证明四氧化三铁存在的试剂是___________。(写名称)
(4)“氧化”过程中,可以用单质碘为氧化剂进行氧化,写出该反应的离子方程式__________。
(5)调节pH=0时,请写出由Na3AsO4制备As2O3的离子方程式_________________。
(6)一定条件下,用雄黄(As4S4)制备As2O3的转化关系如图所示。若反应中,1molAs4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,则物质a为___________。(填化学式)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com