
| ||
| ||
| ||
| 0.8mol |
| 0.8L |
| 0.224L |
| 22.4L/mol |
| 0.224L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| A、用温度计测量出酒精的沸点为78.5℃ |
| B、用50mL量筒量取23.00 mL浓盐酸 |
| C、用广泛pH试纸测得氯水的pH值为2.1 |
| D、用托盘天平称量氧化铜粉末为11.70g |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3- |
| B、CO32- |
| C、Fe(OH)3 |
| D、CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
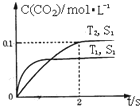 2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.
2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 分子式 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 | 水中溶解性 |
| 甲 | C3H6O2 | -98 | 57.5 | 0.93 | 可溶 |
| 乙 | C4H8O2 | -84 | 77 | 0.90 | 可溶 |
| A、萃取法 | B、升华法 |
| C、蒸馏法 | D、分液法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应SiO2(s)+3C(s)=SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H<0 |
| B、配制硫酸亚铁溶液时,需将FeSO4?7H2O先溶于硝酸再用蒸馏水稀释,最后加少量铁粉 |
| C、0.1 mol?L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度增大,溶液的pH减小 |
| D、在硫酸钡悬浊液中加入足量饱和Na2CO3溶液处理,向所得沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com