
【题目】写出下列物质在水溶液中的电离方程式
(1)Ba(OH)2_____________________________________
(2)H2SO4______________________________________
(3)FeCl3______________________________________
(4)NaHCO3______________________________________a
(5)KHSO4______________________________________
(6)H2CO3______________________________________
【答案】Ba(OH)2=Ba2++2OH- H2SO4=2H++SO42- FeCl3=Fe3++3Cl- NaHCO3=Na++HCO3- KHSO4=K++H++SO42- H2CO3 ![]() H++HCO3-
H++HCO3-
【解析】
试题本题考查电离方程式的书写。
(1)Ba(OH)2属于强碱,在水溶液中电离方程式为Ba(OH)2=Ba2++2OH-。
(2)H2SO4属于强酸,在水溶液中电离方程式为H2SO4=2H++SO42-。
(3)FeCl3属于盐,在水溶液中电离方程式为FeCl3=Fe3++3Cl-。
(4)NaHCO3属于弱酸的酸式盐,在水溶液中电离方程式为:NaHCO3=Na++HCO3-。
(5)KHSO4属于强酸的酸式盐,在水溶液中电离方程式为:KHSO4=K++H++SO42-。
(6)H2CO3属于弱酸,在水溶液中部分电离,电离方程式为:H2CO3 ![]() H++HCO3-。
H++HCO3-。


科目:高中化学 来源: 题型:
【题目】常温下,用0.100mol·L-1的NaOH溶液分别滴定同浓度、体积均为20.00mL的盐酸和醋酸溶液(用HA表示酸),得到2条滴定曲线,如图所示。
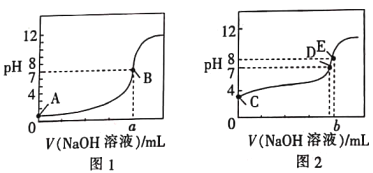
下列说法正确的是
A. 滴定醋酸的曲线是图1
B. 由图分析可得b>a=20
C. D点对应的溶液中:c(Na+)=c(A-)
D. 根据E点可计算得K(HA)=[0.05+(10-6-10-8)]×10-8/(10-6-10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中要配制0.1mol/L 盐酸500mL。请回答下列问题:
(1)实验中用到仪器除量筒、烧杯、玻璃棒外还需用的仪器有:____________________;
(2)实验中应用量筒量取密度为1.19 g/cm3、质量分数为36.5%的浓盐酸_______ mL;
(3)下列操作能引起所配溶液浓度偏高的是_____________ 。
A.取浓盐酸时俯视
B.将浓盐倒出后,洗涤量筒,并将洗涤液倒入烧杯中
C.将稀释后的盐酸转移后,直接加水定容至刻度线
D.定容时俯视
E. 颠倒摇匀后发现液面低于刻度线,但未加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 2A(g)+B(g) 2C(g) ΔH= -a kJ·mol-1(a>0) ,在一个有催化剂、固定容积的容器中加入 2 mol A 和 1 mol B,在 500 ℃时充分反应达到平衡后C 的浓度为 x mol·L-1,放出热量bkJ。请回答下列问题:
(1) a_____b(填“>”、“=”或“ <”)。
(2)下表为不同温度下反应的平衡常数。由此可推知,表中 T1_____ T2(填“>”、“< ”或“ =”)。
T/K | T1 | T2 | T3 |
K | 1.00×107 | 2.54×105 | 1.88×103 |
若在原来的容器中,只加入 2 mol C,500 ℃时充分反应达到平衡后,吸收热量 c kJ,则 C 的浓度_____x mol·L-1(填“>”、“=” 或“ <”),a、b、c 之间满足何种关系?_____(用代数式表示)
(3)在相同条件下要想得到 2a kJ 热量,加入各物质的物质的量可能是_____(填字母)。
A.4 mol A 和 2 mol B B.4 molA、2 mol B 和 2 mol C
C.4 mol A 和 4 mol B D.6 molA 和 4 mol B
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是_____(填字母)。
A.及时分离出C 气体 B.适当升高温度 C.增大 B 的浓度 D.选择高效的催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入 2 mol A 和 1 mol B,500 ℃时充分反应达到平衡后,放出热量 d kJ,则 d_____b(填“>”、“=” 或“ <”),理由是_____。
(6)在一定温度下,在一个容积不变的容器中通入 2 mol A 和 1 mol B 及适量固体催化剂,使反应达到平衡。保持同一反应温度,在相同容器中,将起始物质改为 4 mol A 和 2 mol B,则平衡时A 的转化率_____(填“不变”、“变大”、“变小”或“不能确定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜与稀硫酸不发生反应,但如果在铜与稀硫酸的混合溶液中加入某种盐,就能发生反应,且有气体、有沉淀产生,则该盐是
A.FeCl3B.Ba(NO3)2C.Na2SO4D.KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃能够发生下列反应:2CH3CH2Br+2Na→CH3CH2CH2CH3+2NaBr,下列有机物可以合成环丁烷的是
A. ![]() B.
B. ![]()
C. BrCH2CH2CH2CH2Br D. CH3CH2CH2CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是

A. 用上图所示方法可保护钢闸门不被腐蚀
B. SiO2(s)+2C(s)=Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0
C. 常温下,NH4Cl溶液加水稀释,![]() 增大
增大
D. C(s)+H2O(g)![]() CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动
CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是

A. a和b都属于芳香族化合物 B. b和c都能与新制Cu(OH)2溶液反应
C. a、b和c均能使酸性KMnO4溶液褪色 D. b和c互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com