
【题目】碱金属元素及其单质从Li→Cs性质递变规律正确的是( )
A. 密度逐渐增大B. 熔点逐渐升高
C. 金属性逐渐增强D. 还原性逐渐减弱
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
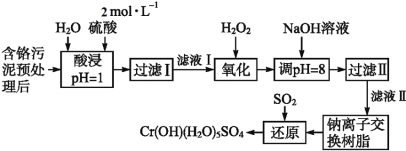
已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)实验室用18.4 mol·L-1的浓硫酸配制480 mL 2 mol·L-1的硫酸,需量取浓硫酸_________mL;配制时所用玻璃仪器除量筒、胶头滴管、烧杯和玻璃棒外,还需__________________________。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:__________。
(3)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O72-转化为CrO42-,写出该反应的离子方程式__________________。
(4)钠离子交换树脂的反应原理为:Mn+ + n NaR = MRn + n Na+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有__________________。
(5)写出上述流程中用SO2进行还原时发生反应的离子方程式:_________________。
(6)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-浓度,可用标准AgNO3溶液滴定待测液,已知:
银盐性质 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 黄 | 白 | 砖红 | 白 |
Ksp | 1.8×10-10 | 8.3×10-17 | 1.2×10-16 | 3.5×10-11 | 1.0×10-12 |
滴定时可选为滴定指示剂的是_________(选填编号),滴定终点现象是:________。
A.NaCl B.K2CrO4 C.KI D.NaCN
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下为中学化学中常见的物质:①Cu; ②1molL﹣1的FeCl3溶液; ③CuCl2溶液;④CO2;⑤H2SO4;⑥酒精;⑦CaCO3;⑧FeSO4;⑨Ba(OH)2
(1)以上物质中属于电解质的是__;属于非电解质的是__.
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入②的溶液,至液体呈透明的红褐色氢氧化铁胶体.则反应的化学方程式为__________________;
(3)将②③⑧混合配制成浓度均为1molL﹣1的混合溶液100mL,加入一定量的铁粉,充分反应后,若铁粉无剩余,且有铜生成.则反应后的溶液中一定含有__阳离子,可能含有__阳离子.
(4)向⑨溶液中逐滴加入稀硫酸,请完成下列问题:
① 写出该反应的离子方程式:______________________________.
② 下列三种情况下,离子方程式与①相同的是__( 填序号).
A.向NaHSO4 溶液中逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4 溶液中逐滴加入Ba(OH)2溶液至SO42﹣恰好完全沉淀
C.向NaHSO4 溶液中逐滴加入Ba(OH)2溶液至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中发生如下可逆反应:2X(g)+Y(s)![]() 3Z(g) ΔH= QkJ/mol,下列说法正确的是
3Z(g) ΔH= QkJ/mol,下列说法正确的是
A. 消耗2 mol X同时生成3 mol Z,说明达到了平衡状态
B. 加入少量的Y正反应速率加快
C. 气体的密度不变时,说明达到了平衡状态
D. 加入少量的X,Q变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2SO3是一种重要的还原剂,I2O5是一种重要的氧化剂,二者都是化学实验室中的重要试剂。
(1)已知:2Na2SO3 (aq)+O2(aq)==2Na2SO4(aq) △H =m kJ·mol-1,O2(g)![]() O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
O2(aq) △H =n kJ·mol-1 ,则Na2SO3溶液与O2(g)反应的热化学方程式为______________________________。
(2)Na2SO3的氧化分富氧区和贫氧区两个阶段,贫氧区速率方程为v=k·ca(SO32-)·cb(O2),k为常数。
①当溶解氧浓度为4.0 mg/L(此时Na2SO3的氧化位于贫氧区)时,c(SO32-)与速率数值关系如下表所示,则a=____。
c(SO32-)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
V×106 | 10.2 | 24.4 | 44.7 | 103.6 |
②两个阶段的速率方程和不同温度的速率常数之比如下表所示。已知1n(k2/k1)=Ea/R(1/T2-1/T1),R 为常数,则Ea(富氧区)______(填“>”或“<”)Ea(贫氧区)。
反应阶段 | 速率方程 | k(297.0K)/k(291.5K) |
富氧区 | v= k·c(SO32-)·c(O2) | 1.47 |
贫氧区 | v= k·ca(SO32-)·cb(O2) | 2.59 |
(3)等物质的量的Na2SO3和Na2SO4混合溶液中,c(SO32-) +c( HSO3-)______(填“>”“<”或“=”)c(SO42-)。
(4)利用I2O5可消除CO 污染,其反应为I2O5(s)+5CO(g) ![]() 5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。
5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2 L 恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2) 随时间t的变化曲线如图所示。

①从反应开始至a点时的平均反应速率v(CO)=__________。
②b点时,CO 的转化率为_____________。
③b点 和 d点 的 化学 平衡常数:Kb____(填“ >”“<”或“=” )Kd,判断的理由是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,浓度均为 0.10 mol/L,体积均为 V0 的 MOH 和ROH 溶液,分别加水稀释至体积 V,pH 随![]() 的变化如图所示。下列叙述正确的是
的变化如图所示。下列叙述正确的是

A. 稀释前两溶液的 Ka : MOH 溶液>ROH 溶液
B. ROH 的电离程度:b 点小于 a 点
C. 两溶液在稀释过程中,c(H+)均逐渐减少
D. 当![]() 时,若两溶液同时升高温度,则c(R+)/c(M+)增大
时,若两溶液同时升高温度,则c(R+)/c(M+)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又属于吸热反应的是( )
A. 锌粒与稀硫酸的反应B. Ca(OH)2与NH4Cl晶体的反应
C. 甲烷在空气中燃烧的反应D. 灼热的木炭与CO2的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质在水溶液中的电离方程式
(1)Ba(OH)2_____________________________________
(2)H2SO4______________________________________
(3)FeCl3______________________________________
(4)NaHCO3______________________________________a
(5)KHSO4______________________________________
(6)H2CO3______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二十四节气是中国历法的独特创造。四月农谚“雷雨肥田”“雨生百谷”描述的都是节气谷雨。下列元素在自然界中的转化与“雷雨肥田”有关的是( )
A.KB.NC.SD.C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com