
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
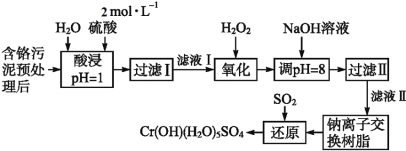
已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)实验室用18.4 mol·L-1的浓硫酸配制480 mL 2 mol·L-1的硫酸,需量取浓硫酸_________mL;配制时所用玻璃仪器除量筒、胶头滴管、烧杯和玻璃棒外,还需__________________________。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:__________。
(3)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O72-转化为CrO42-,写出该反应的离子方程式__________________。
(4)钠离子交换树脂的反应原理为:Mn+ + n NaR = MRn + n Na+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有__________________。
(5)写出上述流程中用SO2进行还原时发生反应的离子方程式:_________________。
(6)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-浓度,可用标准AgNO3溶液滴定待测液,已知:
银盐性质 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 黄 | 白 | 砖红 | 白 |
Ksp | 1.8×10-10 | 8.3×10-17 | 1.2×10-16 | 3.5×10-11 | 1.0×10-12 |
滴定时可选为滴定指示剂的是_________(选填编号),滴定终点现象是:________。
A.NaCl B.K2CrO4 C.KI D.NaCN
【答案】54.3 500mL容量瓶 2Cr3++3H2O2+H2O=Cr2O72-+8H+ Cr2O72-+2 OH- = 2CrO42-+H2O Mg2+、Ca2+ 2CrO42-+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO42- +2OH- B 当滴入最后一滴标准液时,沉淀由白色变为砖红色,且半分钟内沉淀颜色不再改变
【解析】
流程硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,调节pH=8是为了让Fe3+、Al3+转化为氢氧化物沉淀而除去,同时Cr2O72-转化为CrO42-,过滤后,滤液Ⅱ通过钠离子交换树脂是为了除掉Ca2+和Mg2+,通入二氧化硫发生氧化还原反应得到Cr(OH)(H2O)5SO4;
(1)配置一定浓度的溶液要注意用500mL容量瓶,根据步骤确定所需仪器;
(2)三步法配平离子方程式①化合价升降相等配平化合价变化的元素②根据左右两边电荷守恒确定氢离子系数③根据左右两边原子守恒确定水的系数;
(3)利用电荷守恒和原子守恒书写离子方程式;
(4)学会知识迁移,联想硬水的软化就可确定Ca2+和Mg2+,或者根据阳离子互换原则确定;
(5)三步法配平离子方程式①化合价升降相等配平化合价变化的元素②根据左右两边电荷守恒确定氢氧根离子系数③根据左右两边原子守恒确定水的系数;
(6)指示剂选择原则①颜色变化明显②Ksp略微大于AgSCN。
(1)根据C1V1= C2V2列等式,18.4×V1×10-3=2×500×10-3,V1=54.3mL;配制时所用玻璃仪器还需500mL容量瓶;
正确答案:54.3 500mL容量瓶。
(2)三步法配平离子方程式①化合价升降相等配平化合价变化的元素②根据左右两边电荷守恒确定氢离子系数③根据左右两边原子守恒确定水的系数;离子方程式为2Cr3++3H2O2+H2O=Cr2O72-+8H+;
正确答案:2Cr3++3H2O2+H2O=Cr2O72-+8H+。
(3)利用电荷守恒和原子守恒书写离子方程式Cr2O72-+2OH- = 2CrO42-+H2O;
正确答案:Cr2O72-+2 OH- = 2CrO42-+H2O。
(4)根据阳离子互换原则确定,利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有Mg2+、Ca2+;
正确答案:Mg2+、Ca2+。
(5)三步法配平离子方程式①化合价升降相等配平化合价变化的元素②根据左右两边电荷守恒确定氢氧根离子系数③根据左右两边原子守恒确定水的系数;得2CrO42-+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO42- +2OH-;
正确答案:2CrO42-+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO42- +2OH-。
(6)指示剂选择原则①颜色变化明显②Ksp略微大于AgSCN,确定K2CrO4作为指示剂,滴定终点现象是当滴入最后一滴标准液时,沉淀由白色变为砖红色,且半分钟内沉淀颜色不再改变;
正确答案:B 当滴入最后一滴标准液时,沉淀由白色变为砖红色,且半分钟内沉淀颜色不再改变。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 化合物 的分子式为C13H9O4N2
的分子式为C13H9O4N2
B. 在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H![]() OH
OH
C. 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应
D. 甲苯苯环上的一个氢原子被—C3H6Cl取代,形成的同分异构体有9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡: Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:

(1)向K2Cr2O7溶液中加入30% NaOH溶液,溶液呈________色,因为________________。
(2)若向已加入NaOH溶液的(1)中再加入过量稀硫酸,则溶液呈________色,因为____________________________________________________。
(3)向K2Cr2O7溶液中逐滴加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡向着_________方向移动,溶液颜色变化为____________。
(4)对比②和④可得出的结论是______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F( )为一种高分子树脂,其合成路线如下:
)为一种高分子树脂,其合成路线如下:

已知:①A为苯甲醛的同系物,分子中无甲基,其相对分子质量为134;
②
请回答下列问题:
(1)X的化学名称是_________________。
(2)E生成F的反应类型为_________________。
(3)D的结构简式为_________________。
(4)由B生成C的化学方程式为_________________。
(5)芳香族化合物Y是D的同系物,Y的同分异构体能与饱和Na2CO3溶液反应放出气体,分子中只有1个侧链,核磁共振氢普显示有5种不同化学环境的氢,峰值面积比为6:2:2:1:1。写出两种符合要求的Y的结构简式___________、__________。
(6)写出以甲醛、丙醛和乙二醇为主要原料合成软质隐形眼镜高分子材料—聚甲基丙烯酸羟乙酯( )的合成路线(无机试剂自选):_________________。
)的合成路线(无机试剂自选):_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于葡萄糖与蔗糖的说法错误的是( )。
A.二者的分子式不同,但所含化学元素相同
B.蔗糖能水解,葡萄糖不能水解
C.二者互为同分异构体
D.葡萄糖是单糖,能发生银镜反应,蔗糖是双糖,不能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某硫酸铜样品中硫酸铜的含量(杂质不溶于水,不含铜元素,不与其他物质发生反应),进行了如图实验:

(1)上述实验过程中发生反应的化学方程式为______。
(2)根据已知条件列出求解C烧杯中参加反应的硫酸铜质量(X)的比例式___。
(3)配制上述实验所用的氢氧化钾溶液,需要质量分数为40%的氢氧化钾溶液的质量为___。
(4)样品中硫酸铜的质量分数为___。
(5)D烧杯溶液中溶质的质量分数为____。
(6)若用湿法冶金的方法冶炼出100kg含杂质4%的铜,需要这种硫酸铜的质量为多少?(写出计算过程)____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电导率越大导电能力越强。常温下用0.100 mol·L-1NaOH溶液分别滴定10.00mL浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线①代表滴定盐酸的曲线
B. 滴定醋酸的过程应该选择甲基橙作为指示剂
C. a、b、c三点溶液中水的电离程度:c>a>b
D. b点溶液中:c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.100mol·L-1的NaOH溶液分别滴定同浓度、体积均为20.00mL的盐酸和醋酸溶液(用HA表示酸),得到2条滴定曲线,如图所示。
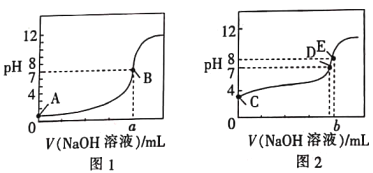
下列说法正确的是
A. 滴定醋酸的曲线是图1
B. 由图分析可得b>a=20
C. D点对应的溶液中:c(Na+)=c(A-)
D. 根据E点可计算得K(HA)=[0.05+(10-6-10-8)]×10-8/(10-6-10-8)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com