
【题目】常温下,用0.100mol·L-1的NaOH溶液分别滴定同浓度、体积均为20.00mL的盐酸和醋酸溶液(用HA表示酸),得到2条滴定曲线,如图所示。
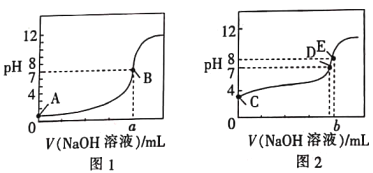
下列说法正确的是
A. 滴定醋酸的曲线是图1
B. 由图分析可得b>a=20
C. D点对应的溶液中:c(Na+)=c(A-)
D. 根据E点可计算得K(HA)=[0.05+(10-6-10-8)]×10-8/(10-6-10-8)
【答案】C
【解析】
A.根据初始酸溶液中氢离子浓度和酸浓度的关系判断;
B、由选项A分析可知图1滴定盐酸且滴定终点溶液呈中性,图2滴定醋酸且滴定终点溶液呈碱性;
C.根据图示可知,D点显示中性,结合电荷守恒可求;
D、根据K(HA)=![]() 计算。
计算。
A.根据图知,图1中A点未加氢氧化钠溶液时溶液的pH=1,由于酸的浓度是0.1mol/L,所以图1中为强酸,即滴定盐酸的曲线是图1,选项A错误;
B、由选项A分析可知图1滴定盐酸且滴定终点溶液呈中性,图2滴定醋酸且滴定终点溶液呈碱性,故b=a=20,选项B错误;
C.根据图示可知,D点显示中性:c(H+)=c(OH-),结合电荷守恒可知:c(Na+)=c(A-),选项C正确;
D、E点pH=8,则c(H+)=10-8mol/L,c(OH-)=10-6mol/L,c(Na+)=0.05mol/L,结合电荷守恒可知: c(A-)=c(Na+)+ c(H+)- c(OH-)=0.05mol/L+10-8mol/L-10-6mol/L,c(HA)= 0.05mol/L-(0.05+10-8-10-6)mol/L= (10-6-10-8)mol/L,K(HA)=![]() =
=![]() ,选项D错误。
,选项D错误。
答案选C。


科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在空气中迅速被氧化成绿色;见光则分解,变成褐色。如图是工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:

根据以上信息回答下列问题:
(1)生产过程中X的化学式为________。
(2)写出产生CuCl的化学方程式:__________________________________________。
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由_____________________________________________________
实际生产中SO2要适当过量,原因可能是_______________________________(答一点即可)。
(4)实验探究pH对CuCl产率的影响如下表所示:
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl产率/% | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出CuCl晶体最佳pH为________,当pH较大时CuCl产率变低,原因是________________________________________________________________________。调节pH时,________(填“能”或“不能”)用相同pH的硝酸代替硫酸,理由__________________。
(5)氯化亚铜的定量
①称取样品0.25 g和过量的FeCl3溶液于锥形瓶中,充分溶解。
②用0.10 mol·L-1硫酸铈标准溶液滴定。已知:CuCl+FeCl3===CuCl2+FeCl2、Fe2++Ce4+===Fe3++Ce3+。三次平行实验结果如下(平行实验结果相差不能超过1%):
平行实验次数 | 1 | 2 | 3 |
0.25 g样品消耗硫酸铈 标准溶液的体积/mL | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为________(结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
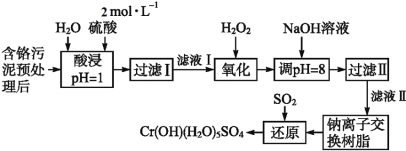
已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)实验室用18.4 mol·L-1的浓硫酸配制480 mL 2 mol·L-1的硫酸,需量取浓硫酸_________mL;配制时所用玻璃仪器除量筒、胶头滴管、烧杯和玻璃棒外,还需__________________________。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:__________。
(3)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O72-转化为CrO42-,写出该反应的离子方程式__________________。
(4)钠离子交换树脂的反应原理为:Mn+ + n NaR = MRn + n Na+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有__________________。
(5)写出上述流程中用SO2进行还原时发生反应的离子方程式:_________________。
(6)沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-浓度,可用标准AgNO3溶液滴定待测液,已知:
银盐性质 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 黄 | 白 | 砖红 | 白 |
Ksp | 1.8×10-10 | 8.3×10-17 | 1.2×10-16 | 3.5×10-11 | 1.0×10-12 |
滴定时可选为滴定指示剂的是_________(选填编号),滴定终点现象是:________。
A.NaCl B.K2CrO4 C.KI D.NaCN
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~F为初中化学常见的六种物质,且都含有一种相同元素,它们相互间的关系如图所示。已知A、B、C、D、E是不同类别的物质,C俗称纯碱,F是人体中含量最多的物质。(部分反应物、生成物及反应条件己略去)

请回答:
(1)写出B、D、F的化学式:B____,D____,F_____。
(2)写出B物质的一种用途_____,C与E反应的化学方程式是_________。
(3)图中物质相互间发生的反应。未涉及的基本反应类型是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
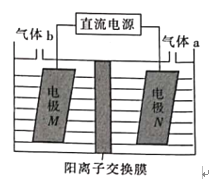
【题目】利用如图所示装置可制备LiOH,两电极区电解液分别为LiCl溶液和LiOH溶液。下列说法错误的是

A. B极区的电极反应式2H2O+2e-=H2↑+2OH-
B. A极的电势一定比B极的高
C. 实际电解过程中A极区pH减小
D. 若改为阴离子交换膜,则两极气体产物仍相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界能源消费的90%以上依靠化学技术。回答下列问题:
(1)质子交换膜燃料电池中作为燃料的H2通常来自水煤气。
已知:C(s)+![]() O2(g)=CO(g) △H1=-110.35kJ·mol-1
O2(g)=CO(g) △H1=-110.35kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
H2O(1)=H2O(g) △H3=+44.0kJ·mol-1
则反应C(s)+H2O(g)![]() CO(g)+H2(g) △H4=___________。
CO(g)+H2(g) △H4=___________。
某实验小组在实验室模拟反应C(s)+H2O(g)![]() CO(g)+H2(g),其平衡常数表达式为K=___________。一定温度下,在2L盛有足量炭粉的恒容密闭容器中通入0.8molH2O,6min时生成0.7gH2。则6min内以CO表示的平均反应速率为___________(保留3位有效数字)。
CO(g)+H2(g),其平衡常数表达式为K=___________。一定温度下,在2L盛有足量炭粉的恒容密闭容器中通入0.8molH2O,6min时生成0.7gH2。则6min内以CO表示的平均反应速率为___________(保留3位有效数字)。
(2)燃料气(主要含N2和H2,还含有少量其他杂质)中的CO会使电极催化剂中毒,使用CuO/CeO2催化剂可使CO优先氧化而脱除。CeO2可由草酸铈[Ce(C2O4)3]灼烧制得,反应的化学方程式为___________。在CuO/CeO2催化剂中加入不同的酸(HIO3或H3PO4),测得燃料气中CO优先氧化的转化率随温度的变化如下图所示。
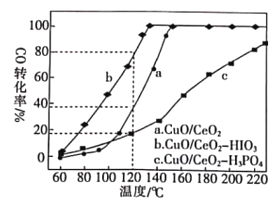
加入H3PO4___________(填“促进”或“抑制”)CuO/CeO2的催化。温度为120℃,催化剂为CuO/CeO2-HIO3时,若燃料气流速为1800mL·min-1,CO的体积分数为0.68%,则反应0.5h后CO的体积为___mL。
(3)LiOH是制备锂离子电池正极材料的重要原料,利用LiCl溶液电解制备得LiOH的装置如下图,LiOH在___________(填“M极”或“N极”)制得,N极产生的气体a通入淀粉KI溶液溶液变蓝,持续一段时间后,蓝色可逐渐褪去。据此写出N极的电极反应式:__________,蓝色逐渐褪去是因为溶液中逐渐生成HIO3,写出此反应的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下为中学化学中常见的物质:①Cu; ②1molL﹣1的FeCl3溶液; ③CuCl2溶液;④CO2;⑤H2SO4;⑥酒精;⑦CaCO3;⑧FeSO4;⑨Ba(OH)2
(1)以上物质中属于电解质的是__;属于非电解质的是__.
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入②的溶液,至液体呈透明的红褐色氢氧化铁胶体.则反应的化学方程式为__________________;
(3)将②③⑧混合配制成浓度均为1molL﹣1的混合溶液100mL,加入一定量的铁粉,充分反应后,若铁粉无剩余,且有铜生成.则反应后的溶液中一定含有__阳离子,可能含有__阳离子.
(4)向⑨溶液中逐滴加入稀硫酸,请完成下列问题:
① 写出该反应的离子方程式:______________________________.
② 下列三种情况下,离子方程式与①相同的是__( 填序号).
A.向NaHSO4 溶液中逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4 溶液中逐滴加入Ba(OH)2溶液至SO42﹣恰好完全沉淀
C.向NaHSO4 溶液中逐滴加入Ba(OH)2溶液至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中发生如下可逆反应:2X(g)+Y(s)![]() 3Z(g) ΔH= QkJ/mol,下列说法正确的是
3Z(g) ΔH= QkJ/mol,下列说法正确的是
A. 消耗2 mol X同时生成3 mol Z,说明达到了平衡状态
B. 加入少量的Y正反应速率加快
C. 气体的密度不变时,说明达到了平衡状态
D. 加入少量的X,Q变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质在水溶液中的电离方程式
(1)Ba(OH)2_____________________________________
(2)H2SO4______________________________________
(3)FeCl3______________________________________
(4)NaHCO3______________________________________a
(5)KHSO4______________________________________
(6)H2CO3______________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com